
分析 (1)根据质量守恒定律计算生成氢气的质量;
(2)根据生成氢气的质量,依据化学方程式进行计算.
解答 解:(1)生成氢气的质量为:20g+50g-69.8g=0.2g
设参加反应的锌的质量为x,生成硫酸锌质量为y
Zn+H2SO4=ZnSO4+H2↑
65 161 2
x y 0.2g
$\frac{65}{x}$=$\frac{161}{y}$=$\frac{2}{0.2g}$
x=6.5g
y=16.1g
样品中锌的质量分数为:$\frac{6.5g}{20g}$×100%=32.5%;
恰好完全反应后所得溶液中溶质的质量分数为:$\frac{16.1g}{50g+6.5g-0.2g}$×100%≈28.6%.
故答案为:(1)32.5%;
(2)恰好完全反应后所得溶液中溶质的质量分数为28.6%.
点评 本题难度不大,掌握根据化学方程式的计算即可正确解答本题,根据质量守恒定律计算出氢气的质量是正确解答本题的前提和关键.


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:初中化学 来源: 题型:解答题
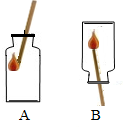 将两装满氧气的集气瓶,按如图所示,用带火星的木条分别用A、B两种方式迅速插入,观察到木条复燃,且在A中燃烧比在B中燃烧更旺.从以上实验现象可知氧气的性质有:
将两装满氧气的集气瓶,按如图所示,用带火星的木条分别用A、B两种方式迅速插入,观察到木条复燃,且在A中燃烧比在B中燃烧更旺.从以上实验现象可知氧气的性质有:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 物质序号 | 甲 | 乙 | 丙 | 丁 | 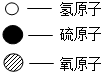 |
| 微观示意图 |  |  |  |  | |
| 反应前质量/g | 34 | 50 | 1 | 0 | |
| 反应后质量/g | 0 | x | y | z |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
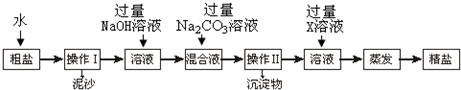

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com