



分析 【方案一】(1)欲检查装置气密性,可根据该反应容器的特点,采用拉动注射器活塞的方法完成;
(2)根据二氧化碳易溶于水,形成碳酸,所以测得的二氧化碳体积会变小进行分析;
(3)根据碱石灰可以吸收氯化氢、水蒸气、二氧化碳进行分析;
【方案二】(1)从判断CaCl2过量,主要是看Na2CO3是否有剩余,因此再加入CaCl2后若无沉淀生成则说明氯化钙已过量;
(2)根据碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠进行分析;
【方案三】(1)根据盐酸溶液与碳酸钠的反应会生成气泡这一明显现象进行分析;
(2)利用反应方程式反应前后固体的质量差进行解决.
解答 解:【方案一】(1)若装置漏气,拉出的活塞不移动,若不漏气,拉出的活塞在大气压强的作用下应回到原来的位置;
(2)因为二氧化碳不仅能溶于水还能与水反应,用排水法收集气体,收集的二氧化碳偏小,该气体排开水的体积即为测量的气体体积,故原广口瓶中的气体对测量的结果没有影响;
(3)A、装置内残留的CO2气体不能全部排出,导致碱石灰增加的质量偏小,实验结果偏小,故A错误;
B、产生的CO2气体中混有氯化氢气体,同时被碱石灰吸收,导致碱石灰增加的质量偏大,实验结果偏大,故B正确;
C、产生的CO2气体中混有水蒸气,同时被碱石灰吸收,导致碱石灰增加的质量偏大,实验结果偏大,故B正确;
D、球形干燥管与空气相通,也会吸收空气中的CO2和H2O,导致碱石灰增加的质量偏大,实验结果偏大,故B正确;
故选:BCD;
【方案二】(1)判断是否过量,主要看溶液中是否还有CO32-,因此将溶液静置,向上层清液中继续滴加CaCl2溶液,若无沉淀说明CaCl2溶液已过量;
(2)碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,化学方程式为:Na2CO3+CaCl2=CaCO3↓+2NaCl;
【方案三】(1)盐酸滴加到溶液中会与碳酸钠反应生成二氧化碳气泡这一现象非常明显;
(2)设参加反应的Na2CO3的质量为x,
Na2CO3+2HCl=2NaCl+H2O+CO2↑ 固体质量增加
106 117 117-106=11
x 0.55g
$\frac{106}{x}$=$\frac{11}{0.55g}$
x=5.3g
所以Na2CO3的质量分数为:$\frac{5.3g}{10g}$×100%=53%.
故答案为:【方案一】(1)将注射器活塞拉出一定距离,一段时间后松开活塞,活塞能回到原位则不漏气;
(2)偏小,CO2能溶于水且与水反应,没有;
(3)BCD;
【方案二】(1)静置,向上层清液中继续滴加CaCl2溶液,若无沉淀说明CaCl2溶液已过量;
(2)Na2CO3+CaCl2=CaCO3↓+2NaCl;
【方案三】(1)直到不再生成气泡为止;
(2)53%.
点评 本题在分析氢氧化钠的变质时,除考虑发生的化学反应,还用到了必要的实验手段,应注意实验的基本操作的练习和规范.


 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:初中化学 来源: 题型:选择题
| 序号 | 物质 | 杂质 | 除杂方法 |
| A. | MnO2 | KCl | 加水溶解、过滤、洗涤、干燥 |
| B. | CO2 | CO | 空气中点燃 |
| C. | NaOH溶液 | Na2CO3 | 加入稀盐酸至不再产生气泡 |
| D. | ZnCl2溶液 | CuCl2 | 加入足量铁粉充分反应、过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
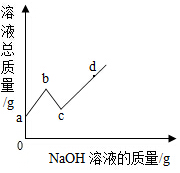 向一定量硫酸和硫酸铜的混合溶液中,逐滴加入一定质量分数的氢氧化钠溶液,直至过量,某同学依据实验事实绘制了如图所示的曲线,下列说法不正确的是( )
向一定量硫酸和硫酸铜的混合溶液中,逐滴加入一定质量分数的氢氧化钠溶液,直至过量,某同学依据实验事实绘制了如图所示的曲线,下列说法不正确的是( )| A. | a至b段对应溶液的pH逐渐增大 | B. | b点对应溶液中的溶质为硫酸钠 | ||
| C. | cd段的溶液滴加石蕊试液变蓝 | D. | c点对应溶液中的溶质种类最少 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
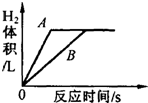 某研究小组将足量的A、B两种金属同时分别放入两份质量分数相同的少量稀盐酸中,根据实验现象,绘制的反应生成H2的体积
某研究小组将足量的A、B两种金属同时分别放入两份质量分数相同的少量稀盐酸中,根据实验现象,绘制的反应生成H2的体积查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 推进太阳能的开发 | B. | 鼓励多开私家车出行 | ||
| C. | 倡导用煤火力发电 | D. | 支持焚烧农作物秸秆 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 燃气灶能效标准将于2015年4月1日正式实施,这标志着与市民生活息息相关的燃气灶将进入节能时代,如图是一款燃气灶的示意图:
燃气灶能效标准将于2015年4月1日正式实施,这标志着与市民生活息息相关的燃气灶将进入节能时代,如图是一款燃气灶的示意图:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com