
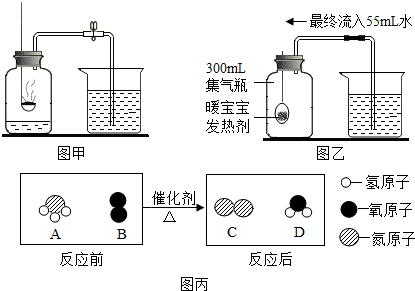
分析 (1)①根据红磷测定空气里氧气含量的实验原理来分析并解答.
②测定空气中氧气含量的实验原理是:红磷燃烧消耗了瓶内的氧气,生成的是固体,使瓶内压强减小,在外界大气压的作用下水被压进集气瓶,进入水的体积就是集气瓶内原来氧气的体积.保证本实验成功的关键是:①装置气密性好;②红磷要足量;③要冷却至室温再读数等,结合红磷测定氧气的原理分析即可.
(2)根据常见的化石燃料包括煤、石油和天然气解答;根据反应的微观示意和质量守恒定律分析该反应生成物的分子个数比.
解答 解:(1)图甲实验中,红磷燃烧生成五氧化二磷,该反应的化学方程式为:4P+5O2$\frac{\underline{\;点燃\;}}{\;}$2P2O5.
(2)
A、铁生锈消耗氧气,使装置内的气压减小,进入水的体积就是消耗氧气的体积,故A正确;
B、如果装置漏气,会使进入的水偏少,测定的结果偏小,故B正确;
C、发热剂的量必须足量,因为只有足量的发热剂才能把氧气消耗完,使结果准确,故C错误;
D、集气瓶内空气的体积是300mL,进入水的体积是55mL,即氧气的体积是55mL,因此氧气的体积分数=$\frac{55mL}{300mL}$×100%=18.3%,故D错误.
(2)常见的化石燃料包括煤、石油和天然气;
①反应的微观示意图可知,该反应是一种单质和一种化合物反应,生成了另一种单质和另一种化合物,属于置换反应.
②根据质量守恒定律可知,反应物中有4个氮原子、12个氢原子、6个氧原子,生成物中有12个氢原子,6个氧原子,只少4个氮原子,所以另一种生成物是氮气,所以NH3燃烧反应的化学方程式是:4NH3+3O2$\frac{\underline{\;点燃\;}}{\;}$6H2O+2N2.由反应的微观示意图和质量守恒定律可知,该反应生成物的分子个数比为:1:3.
答案:
(1)①4P+5O2$\frac{\underline{\;点燃\;}}{\;}$2P2O5 ②CD
(2)天然气 ①置换反应 ②1:3
点评 本题考查了空气中氧气含量的测定,结合红磷测定的原理进行分析,要注意测定原理、实验关键、现象和结论、装置的评价和改进等,能够考查学生的知识迁移能力.


 互动英语系列答案
互动英语系列答案科目:初中化学 来源: 题型:选择题
| A. | 白色粉末中肯定有(NH4)2CO3、NH4Cl和BaCl2 | |
| B. | 白色粉末中肯定没有CuSO4、K2SO4和KCl,可能有NH4Cl | |
| C. | 白色粉末中肯定有(NH4)2CO3和BaCl2,且两者的质量之比大于96:208 | |
| D. | 在滤液中滴加AgNO3溶液,若产生白色沉淀,则该白色粉末中肯定有NH4Cl |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com