
为什么要先检验装置的气密性?
 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:初中化学 来源: 题型:阅读理解
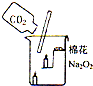 27、过氧化钠(Na2O2)是一种黄色固体.某次科技活动中,某化学兴趣小组的同学将包有Na2O2固体的棉花放入右图烧杯中,缓慢倒人CO2后发现处于下位的蜡烛先熄灭,上位的后熄灭,同时又惊奇的发现棉花燃烧起来.
27、过氧化钠(Na2O2)是一种黄色固体.某次科技活动中,某化学兴趣小组的同学将包有Na2O2固体的棉花放入右图烧杯中,缓慢倒人CO2后发现处于下位的蜡烛先熄灭,上位的后熄灭,同时又惊奇的发现棉花燃烧起来.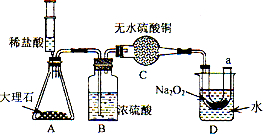
查看答案和解析>>
科目:初中化学 来源: 题型:
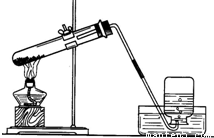
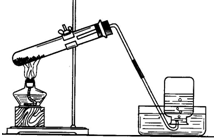 小明设计了如图所示的用加热高锰酸钾制取和收集氧气的实验装置
小明设计了如图所示的用加热高锰酸钾制取和收集氧气的实验装置查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
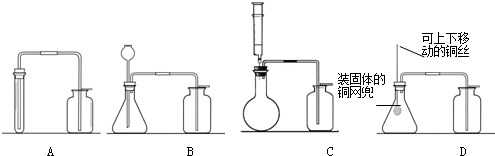
| 制取气体 | 反应物的状态 | 反应条件 | 收集方法和依据 | |
| 氧气 | 固体 | 加热 | 排水集气法 | O2难溶于水 |
| 二氧化碳 | 常温 | |||
| ||
| △ |
| ||
| △ |
| ||
查看答案和解析>>
科目:初中化学 来源:2010-2011学年河南省开封市开封三十三中九年级(上)月考化学试卷(10月份)(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com