
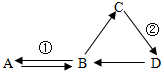
 已知:反应①是实验室制取气体A的常用方法,D常用来改良酸性土壤,它们之间的转化关系如图所示(部分物质和反应条件已略去).图示关系中未涉及到的基本反应类型为置换反应;化学方程式①为CaCO3+2HCl═CaCl2+H2O+CO2↑; ②为CaO+H2O═Ca(OH)2;B在生产或生活中的一种用途是用作建筑材料.
已知:反应①是实验室制取气体A的常用方法,D常用来改良酸性土壤,它们之间的转化关系如图所示(部分物质和反应条件已略去).图示关系中未涉及到的基本反应类型为置换反应;化学方程式①为CaCO3+2HCl═CaCl2+H2O+CO2↑; ②为CaO+H2O═Ca(OH)2;B在生产或生活中的一种用途是用作建筑材料. 分析 碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,二氧化碳能和氢氧化钙反应生成碳酸钙沉淀和水;
高温条件下,碳酸钙分解生成氧化钙和二氧化碳,氧化钙和水反应生成氢氧化钙.
解答 解:碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,二氧化碳能和氢氧化钙反应生成碳酸钙沉淀和水;
高温条件下,碳酸钙分解生成氧化钙和二氧化碳,氧化钙和水反应生成氢氧化钙,因此ABCD分别是二氧化碳、碳酸钙、氧化钙和氢氧化钙;
碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,属于复分解反应;
高温条件下,碳酸钙分解生成氧化钙和二氧化碳,属于分解反应;
氧化钙和水反应生成氢氧化钙,属于化合反应,图示关系中未涉及到的基本反应类型是置换反应;
碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,反应的化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑;
氧化钙和水反应生成氢氧化钙,反应的化学方程式为:CaO+H2O═Ca(OH)2;
碳酸钙在生产或生活中常用作建筑材料.
故填:置换反应;CaCO3+2HCl═CaCl2+H2O+CO2↑;CaO+H2O═Ca(OH)2;用作建筑材料.
点评 本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:初中化学 来源: 题型:实验探究题
| 实验 | 现象 | 结论 |
| 实验一:取滤液,向其中滴入少量碳酸钠溶液 | 无明显现象 | 猜想二不成立 |
| 实验二:另取滤液,向其中加入足量稀盐酸 | 先无变化后产生气泡 | 猜想三成立 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 溶剂质量(g) | 100 | 100 | 100 | 100 | 100 |
| 溶质质量(g) | 0 | 3.6 | 7.5 | 11.1 | 29.9 |
| 凝固点(℃) | 0 | -2.3 | -4.2 | -6.3 | -21 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 10mL酒精和10mL水混合后体积小于20mL,是因为分子间有间隔 | |
| B. | 缉毒犬能根据气味发现毒品,是因为分子在不断地运动 | |
| C. | 水电解能生成氢气和氧气,是因为分子在化学变化中可以分解为原子 | |
| D. | 金刚石和石墨物理性质差异较大是因为构成其碳原子的结构不同 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 物质 | K2CO3 | K2SO | KMnO4 |
| 溶解度/g | 111 | 11.1 | 6.34 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com