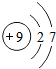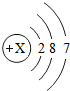(2012?鞍山一模)比较与分析归纳会使你变得更聪明.请分析下表中信息,回答有关问题:
| 名称 |
符号 |
原子结构示意图 |
单质的
化学式 |
常温常压下
状态 |
单质与氢气反应 |
| 氟 |
F |
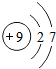 |
F2 |
气态 |
黑暗处爆炸 |
| 氯 |
Cl |
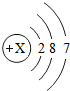 |
Cl2 |
气态 |
光照爆炸 |
| 溴 |
Br |
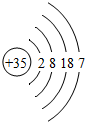 |
Br2 |
液态 |
加热反应 |
| 碘 |
I |
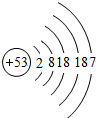 |
I2 |
固态 |
持续加热缓慢反应 |
(1)上述表中X=
17
17
;
(2)①试归纳氟、氯、溴、碘的原子结构规律(答一点即可):
随着原子核电荷数的增加,电子层数也逐渐增加(最外层电子数相同)
随着原子核电荷数的增加,电子层数也逐渐增加(最外层电子数相同)
;
②试归纳氟、氯、溴、碘对应单质的性质变化规律(答一点即可):
随着原子核电荷数的增加,其在常温常压下单质的状态由气态逐渐变为液态、固态
(或随着原子核电荷数的增加,其单质的化学活泼性逐渐减弱)
随着原子核电荷数的增加,其在常温常压下单质的状态由气态逐渐变为液态、固态
(或随着原子核电荷数的增加,其单质的化学活泼性逐渐减弱)
;
(3)已知:Cl
2和Br
2的化学性质相似,Cl
2+H
2O=HCl+HClO,其中HClO也是一种酸,它与氢氧化钠溶液反应的反应方程式为:HClO+NaOH=NaClO+H
2O,试分别写出Br
2与水,Br
2与NaOH溶液反应的化学方程式:
Br2+H2O=HBr+HBrO
Br2+H2O=HBr+HBrO
;
Br2+2NaOH=NaBrO+NaBr+H2O
Br2+2NaOH=NaBrO+NaBr+H2O
.