

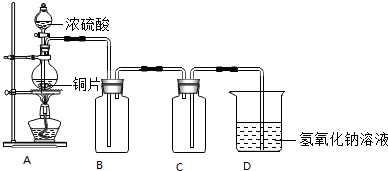
分析 (1)根据二氧化硫的密度比空气大分析;
(2)根据二氧化硫有毒、能与氢氧化钠反应分析回答;
(3)根据稀硫酸显酸性分析;
(4)根据以铜片与浓硫酸为原料用上述方法制取硫酸铜的过程等分析回答.
解答 解:(1)由于二氧化硫的密度大于空气,应利用向上排空气法收集,导气管应伸入到接近瓶底.见下图:
(2)由于二氧化硫有毒、能与氢氧化钠反应,所以.装置D的作用是吸收二氧化硫,防止污染空气.
(3)由于生成物中含有硫酸铜,在加入氯化钡时能产生沉淀对硫酸的存在的判断产生了干扰;硫酸显酸性,所以,能证明浓硫酸有剩余的是实验1.
(4)由制取的过程可知,存在的缺陷有:消耗大量的能量,产生了有毒的气体,浓硫酸随着反应进行,浓度变小成为稀硫酸,稀硫酸不再和铜发生反应等.
故答案为:(1)见上图;(2)吸收二氧化硫,防止污染空气;(3)实验1;(4)消耗大量的能量,产生了有毒的气体.
点评 本题属于实验设计题,排在氢后的金属不与酸发生置换反应,但是可以和强氧化性的酸反应,浓硫酸具有强氧化性,完成本题,可以从题干给出的内容,提取有用的信息,分析归纳从而得出合理的答案,本考点主要出现在实验题中.


科目:初中化学 来源: 题型:选择题
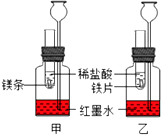 小丽在室温条件下进行如图所示实验,试管内的镁条和铁片表面均被打磨洁净,且形状、大小均相同同时加入两支试管中的稀盐酸的质量和质量分数均相等,下列说法错误的是( )
小丽在室温条件下进行如图所示实验,试管内的镁条和铁片表面均被打磨洁净,且形状、大小均相同同时加入两支试管中的稀盐酸的质量和质量分数均相等,下列说法错误的是( )| A. | 该实验可以用于比较镁、铁与稀盐酸反应的剧烈程度 | |
| B. | 该实验的目的可能是比较相同时间内镁、铁与稀盐酸反应放出热量的多少 | |
| C. | 两支长颈漏斗中,甲装置长颈漏斗中的液面与乙装置中的一样高 | |
| D. | 若实验所用的金属均过量,则甲装置中产生的H2比乙装置中产生的H2质量相等 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 物质 | 杂质 | 除杂试剂或操作方法 |
| A | 熟石灰 | 石灰石 | 高温煅烧 |
| B | 硝酸钠溶液 | 硫酸钠 | 加入适量氯化钡溶液,再过滤 |
| C | 硫酸铁溶液 | 硫酸 | 加入过量氧化铁粉末,再过滤 |
| D | 铁粉 | 氧化铁粉末 | 加入过量稀盐酸,充分反应后过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | SO42-、Cl-、Na+、H+ | B. | K+、SO42-、Cu2+、NO3- | ||
| C. | Cl-、K+、SO42-、Na+ | D. | Ca2+、Na+、CO32-、Cl- |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 实验步骤 | 实验现象 |
| ①将固体研磨成粉末状,加水搅拌 | 固体没有全部溶解 |
| ②取上层清液,滴加酚酞试液 | 溶液呈红色 |
| ③取不溶物,滴加稀盐酸 | 有气泡产生 |
| A. | 一定含有CaCO3 和Ca(OH)2 | B. | 一定含有Ca(OH)2,可能含有CaCO3 | ||
| C. | 一定没有CaCO3 和Ca(OH)2 | D. | 一定含有CaCO3,可能含有Ca(OH)2 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
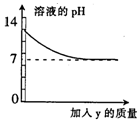 烧杯中盛有x溶液,逐滴加入(或通入)y物质,烧杯内液体的pH值变化如图所示.则符合该变化的一组物质是( )
烧杯中盛有x溶液,逐滴加入(或通入)y物质,烧杯内液体的pH值变化如图所示.则符合该变化的一组物质是( )| x | y | |
| A | NaOH溶液 | 稀HCl(过量) |
| B | 稀H2SO4 | BaCl2溶液(少量) |
| C | Ca(OH)2 | CO2(适量) |
| D | 稀H2SO4 | H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 自然界中甲元素只以化合物形式存在,乙元素有单质形式存在 | |
| B. | 甲能与盐酸反应而乙不能 | |
| C. | 甲能从乙的盐溶液中置换出乙 | |
| D. | 化合物中甲元素显+2 价而乙元素显+3 价 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com