
【题目】化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究
【提出问题】金属与盐酸反应剧烈程度受哪些因素的影响?
【作出猜想】a、可能与金属本身的性质有关
b、可能与盐酸的浓度有关
【设计探究】实验所用金属均已用砂纸打磨.
实验(1)为探究猜想a,小组同学分别在两支试管中放入相同质量的锌片和铁片,然后分别加入相同尝试和质量的稀盐酸,观察到放锌片的试管中立即产生大量气泡,放铁片的试管中只产生少量气泡,发生反应的化学方程式有 .
从实验现象可判断:金属活动性Zn Fe(填“<”“=”“>”).
得出结论:金属与盐酸发生反应的剧烈程度与金属本身性质有关,金属的活动性与反应的剧烈程度的关系是 .
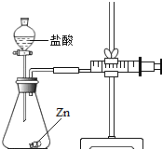
实验(2)为探究猜想b,小组同学设计如图的装置进行实验,其中注射器的作用是 .所用药品,实验数据如下表:
实验编号 | 选用金属(均取2g) | 盐酸质量分数(均取50mL) | 每分钟产生氢气的体积/mL | |||||
1分钟 | 1﹣2分钟 | 2﹣3分钟 | 3﹣4分钟 | 4﹣5分钟 | 前5分钟共收集气体 | |||
Ⅰ | 锌片 | 15% | 2.9 | 16.9 | 11.0 | 9.2 | 7.6 | 48.5 |
Ⅱ | 锌片 | 5% | 1.6 | 8.4 | 5.9 | 4.8 | 3.7 | 24.4 |
得出结论:金属与盐酸发生反应的剧烈程度与盐酸的浓度有关,其关系是
.
【反思评价】根据表一中实验Ⅱ数据分析,请描述锌与盐酸发生反应快慢的变化情况并解释原因
通过以上探究,你认为金属与盐酸反应的剧烈程度可能还受哪些因素的影响 (写一条即可).
【拓展延伸】很多金属不仅能与酸反应,也能与盐酸溶液反应,现将a g铁钉投入到CuSO4溶液中,反应一段时间后,将固体取出洗净、烘干,称重为b g,则生成铜的质量为 .
【答案】【设计探究】Zn+2HCl=ZnCl2+H2↑;Fe+2HCl=FeCl2+H2↑;>得出结论:活动性较强的金属与酸反应更剧烈 实验(2)量取生成气体的体积得出结论:相同条件下,金属与酸反应生成氢气的剧烈程度与酸的浓度有关【反思评价】锌与盐酸反应产生气体的速度先加快后变慢,因为锌与盐酸是放热反应,所以开始时温度升高,产生气体速度加快,随着反应的进程,盐酸不断被消耗,浓度降低,产生气体速度变慢.固体的表面积【拓展延伸】8(b﹣a)g
【解析】
试题分析:【设计探究】由题意知:反应物、生成物,根据质量守恒定律,正确书写化学方程式;如锌与盐酸反应:反应物为锌与盐酸,生成物为氯化锌与氢气,根据质量守恒定律,故正确书写化学方程式Zn+2HCl=ZnCl2+H2↑;铁与盐酸反应的化学方程式Fe+2HCl=FeCl2+H2↑;放锌片的试管中立即产生大量气泡,放铁片的试管中只产生少量气泡,金属活动性Zn>Fe得出结论:根据金属的活动性顺序,金属的活动性与反应的剧烈程度的关系是活动性较强的金属与酸反应更剧烈;实验(2)注射器的作用是量取生成气体的体积;得出结论:相同条件下,金属与酸反应生成氢气的剧烈程度与酸的浓度有关;【反思评价】锌与盐酸反应产生气体的速度先加快后变慢,因为锌与盐酸是放热反应,所以开始时温度升高,产生气体速度加快,随着反应的进程,盐酸不断被消耗,浓度降低,产生气体速度变慢.金属与盐酸反应的剧烈程度可能受固体的表面积、反应物的状态、催化剂的影响;
【拓展延伸】
设生成Cu的质量为m,则:
Fe+CuSO4=Cu+FeSO4 质量增加△m
56 64 8
ag m (b﹣a)g
![]()
m=8(b﹣a)g


科目:初中化学 来源: 题型:
【题目】玫瑰花中含有香茅醇、橙花醇和丁香油酚等物质;请计算:
(1)丁香油酚(C10H12O2)的相对分子质量为 ;
(2)丁香油酚中碳、氢、氧三种元素的质量比 ;
(3)丁香油酚中碳元素的质量分数 (结果精确到0.1%);
(4)16.4g丁香油酚中含 g氧元素(结果精确到0.1g).
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据下列实验装置回答问题:
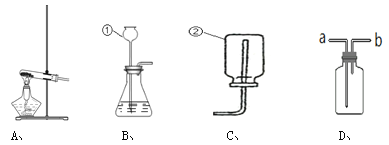
(1)写出上述图中部分仪器的名称:① ;② 。
(2)使用A装置制取气体,反应物的状态要求是: 。
(3)用C装置可以收集O2、CH4、NH3、Cl2中的 (填化学式)。
(4)既可以用来制取O2,用可以用来制取H2和CO2的发生装置是: (填字母序号),若用该装置制取O2,反应的化学方程式为: 。
(5)实验室制取气体是,组装好仪器后进行的必要操作是: ;若用D装置收集二氧化碳气体,应从 (填 a 或 b)端短通入气体。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】“生态安全环境治理”是生态文明贵阳国际论坛2014年年会的一个主题.化学在防治大气污染和水污染方面发挥了重要作用,使更多的化学生产工艺和产品向着环境友好的方向发展.
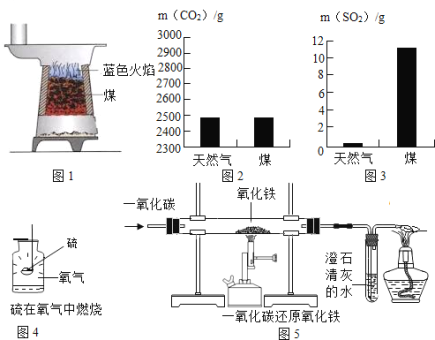
(1)根据图1,如果把煤燃烧看做是C与O2的反应,燃烧的煤炉里可能发生的化学反应共有 个.为使煤充分燃烧,合理的做法是 (写一种做法),这对于节约能源非常重要.
(2)为从源头消除污染,人们在生产、生活中选择对环境影响小的燃料.充分燃烧1kg天然气和煤所产生的二氧化碳和二氧化硫质量如图2、3所示,通过比较选择 燃烧对环境影响较小.随着科技发展,氢气将会成为主要能源之一,氢气在空气中燃烧的反应方程式为 ,请比较分析选用氢气作为能源的优点是 .
(3)火力发电厂为防止环境污染需将燃烧产生的二氧化碳进行处理,其原理是2CaCO3+2SO2+O2═2CaSO4+2 (补充完整化学反应方程式),这样可以减少酸雨的形成.
(4)造纸厂会产生大量含NaOH的碱性废水,可用 (填化学式)中和处理达标后再排放,从而防止水体污染
(5)保护环境从我做起
①图4实验,集气瓶里放入水量水的主要目的是 .
②图5实验,酒精灯的作用是 ,为使该套装置既达到防止空气污染又起节约资源的目的,你的改进方法是 .
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在细菌作用下,可以用氨气处理含有甲醇(CH3OH)的工业废水,有关反应的化学方程式为5CH3OH + 12O2 + 6NH3 = 3N2 + 5X + 19H2O,则X的化学式为( )
A.NO B.CO2 C.H2 D.CO
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列实验的实验现象与实验结论都正确的是
实验操作 | 实验现象 | 实验结论 | |
A | 将一根未打磨的铝条放入硫酸铜溶液中 | 无紫红色固体析出 | 铝不如铜活泼 |
B | 将带火星的木条伸入氧气中 | 木条复燃 | 氧气能支持燃烧 |
C | 将CO通过灼热的氧化铜 | 黑色氧化铜变成红色 | CO具有可燃性 |
D | 将氢氧化钠固体加入水中 | 溶液温度升高 | 氢氧化钠固体与水反应放热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com