
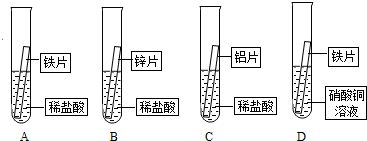
锌和铝的活动性强于铁,为什么常将它们镀在铁制品的表面保护铁制品?
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 实验步骤 | 实验现象 | 实验结论 |
| 取适量镉、铜、银于试管中,加入足量盐酸 | 镉表面有气泡产生,铜、银表面无气泡产生 | 镉的活动性比铜和银强 镉的活动性比铜和银强 |
| 取适量铜于试管中,加入少量硝酸银溶液 | 铜表面析出银白色的固体 铜表面析出银白色的固体 |
铜的活动性顺序大于银 |
查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com