
若用实验证明Fe2(SO4)3溶液显黄色不是由SO42-造成的,下列实验无意义的是( )
A.观察Na2SO4溶液的颜色
B.向Fe2(SO4)3溶液中滴加适量氢氧化钠溶液,振荡后静置,溶液黄色消失
C.向Fe2(SO4)3溶液中滴加适量无色氯化钡溶液,振荡后静置,溶液黄色未消失
D.加水稀释Fe2(SO4)3溶液后,溶液黄色变浅
 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:初中化学 来源: 题型:阅读理解
| ||
| ||

查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
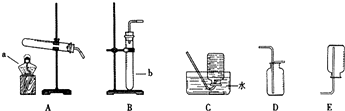 (I)请结合下图所示实验装置回答有关问题:
(I)请结合下图所示实验装置回答有关问题:
| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 实验步骤 | 实验现象 | 结论 |
| 先用PH试纸测定稀硫酸的PH,再逐渐滴加氢氧化钠溶液,并不断振荡,同时测定混合液的PH. | PH逐渐变大, 最后 PH≥7 |
稀硫酸与氢氧化钠溶液能发生反应 |
| 实 验 步 骤 | 实验现象 | 结论 |
| 稀硫酸与氢氧化钠溶液反应放热 |
| 实验步骤 | 实验现象 | 结论 |
| 取少量上述反应后的溶液于试管中,滴加硫酸铜溶液. | 若 生成蓝色沉淀 生成蓝色沉淀 |
氢氧化钠溶液过量 |
| 若没有明显现象 | 稀硫酸与氢氧化钠溶液恰好完全反应 |
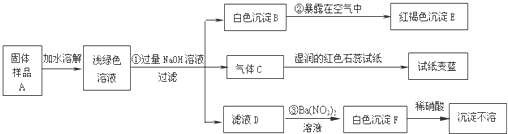
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com