
| A. | CO2气体(CO)→点燃 | |
| B. | MnO2固体(KCl)→加水溶解,过滤,洗涤,干燥 | |
| C. | CO2气体(HCl)→通入NaOH溶液中 | |
| D. | KCl溶液(K2CO3)→加稀H2SO4 |
分析 根据原物质和杂质的性质选择适当的除杂剂和分离方法,所谓除杂(提纯),是指除去杂质,同时被提纯物质不得改变.除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质.
解答 解:A、除去二氧化碳中的一氧化碳不能够点燃,这是因为当二氧化碳(不能燃烧、不能支持燃烧)大量存在时,少量的一氧化碳是不会燃烧的;故选项所采取的方法错误.
B、氯化钾易溶于水,二氧化锰难溶于水,可采取加水溶解、过滤、洗涤、干燥的方法进行分离除杂,故选项所采取的方法正确.
C、CO2和HCl气体均能与NaOH溶液反应,不但能把杂质除去,也会把原物质除去,不符合除杂原则,故选项所采取的方法错误.
D、K2CO3能与稀H2SO4反应生成硫酸钾、水和二氧化碳,能除去杂质但引入了新的杂质硫酸钾,不符合除杂原则,故选项所采取的方法错误.
故选:B.
点评 物质的分离与除杂是中考的重点,也是难点,解决除杂问题时,抓住除杂质的必需条件(加入的试剂只与杂质反应,反应后不能引入新的杂质)是正确解题的关键.


科目:初中化学 来源: 题型:解答题
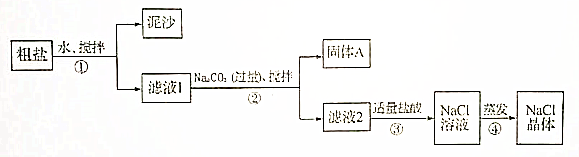
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
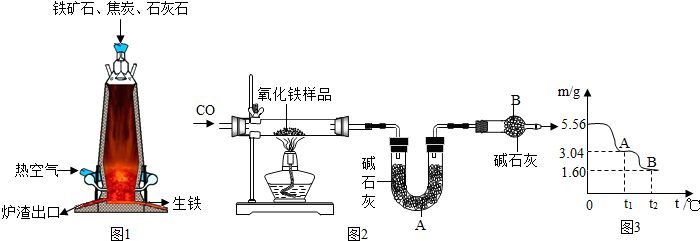
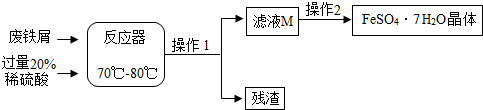
| 温度t/℃ | 0 | 10 | 30 | 40 | 50 | 60 | 64 | 70 | 80 | 90 |
| 溶解度S/g | 15.6 | 20.5 | 33.0 | 40.4 | 48.8 | 55.0 | 55.3 | 50.6 | 43.7 | 37.2 |
| 析出晶体 | FeSO4•7H2O | FeSO4•4H2O | FeSO4•H2O | |||||||
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 在对蜡烛及其燃烧进行了探究以后,请你填写下列空格:
在对蜡烛及其燃烧进行了探究以后,请你填写下列空格:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 某化学兴趣小组的同学在学习了纯碱(Na2CO3)的性质后,联想到家中蒸制馒头时常用的物质小苏打(NaHCO3),于是采用市售的小苏打样品进行了如下实验探究.
某化学兴趣小组的同学在学习了纯碱(Na2CO3)的性质后,联想到家中蒸制馒头时常用的物质小苏打(NaHCO3),于是采用市售的小苏打样品进行了如下实验探究.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 根据如图所示的家庭小实验回答:
根据如图所示的家庭小实验回答:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 (1)气泡爽是一种冲调饮料,其主要成分是柠檬酸(C6H8O7)和碳酸氢钠(NaHCO3);使用时将一包汽泡爽粉末倒入玻璃杯中,加入200mL凉开水,看到有大量气泡快速产生,待粉末完全溶解,就得到一杯果味饮料.
(1)气泡爽是一种冲调饮料,其主要成分是柠檬酸(C6H8O7)和碳酸氢钠(NaHCO3);使用时将一包汽泡爽粉末倒入玻璃杯中,加入200mL凉开水,看到有大量气泡快速产生,待粉末完全溶解,就得到一杯果味饮料.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com