
【题目】碳酸亚铁(FeCO3)可用于制作补铁药物,以下是用硫铁矿烧渣(主要成分为 Fe2O3、SiO2 等)为原料制备碳酸亚铁的生产流程示意图:
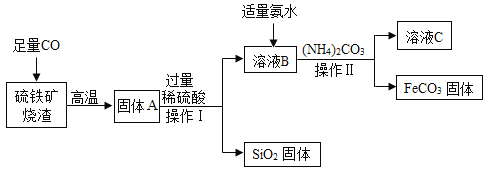
[资料]40℃以上时,(NH4)2CO3 易分解
(1)操作 I 所用到的玻璃仪器有烧杯、玻璃棒和 _____。
(2)加入(NH4)2CO3 后,该反应必须控制的条件是 _____。
(3)从溶液 C 中可回收一种化工产品——(NH4)2SO4,请写出它的一种用途: _____。
科目:初中化学 来源: 题型:
【题目】下图①、②是氧元素、钙元素在元素周期表中的信息,A、B、C、D是四种粒子的结构示意图。
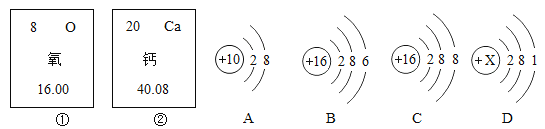
(1)氧元素的相对原子质量为_________,钙元素的质子数为________;
(2)D中的X=________;
(3)以上A、B、C、D粒子结构示意图中,表示稀有气体元素的原子的是________(填元素符号);
(4)B和______属于同种元素的粒子(用“A”、“C”、“D”填空)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】水是一种常见的物质,在生产生活中发挥着重要的作用.
(l)把少量下列物质分别放入水中,充分搅拌,可以得到溶液的是_____(填字母).
A 食盐 B 面粉 C 汽油 D 味精
(2)在盛有水的烧杯中加入以下某种物质,形成溶液过程中,温度上升.这种物质可能是_____(填字母).
A 硝酸铵 B 氢氧化钠 C 氯化钠 D 蔗糖
(3)甲和乙两种固体物质的溶解度曲线如图所示,回答下列问题:

①t1℃时,甲物质的溶解度是_____.
②将t2℃乙物质的不饱和溶液变成饱和溶液,其中一种可行的方法是_____(填“增加水”或“增加乙物质”)
③t3℃时将等质量的甲和乙两种物质配置成饱和溶液,需要水的质量甲_____乙(填“大于”、“小于”、“等于”)
④将等质量的t3℃时甲乙两物质的饱和溶液,降温至t2℃,析出晶体最多的是_____.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为了测定某医用双氧水中H2O2的浓度,某兴趣小组取10g样品设计如图装置进行实验(实验在常温下进行,O2在水中的溶解情况忽略不计,密度为1.43g/L),实验数据如下:
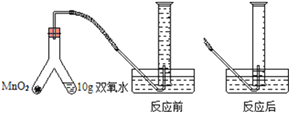
时间/s | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 | 110 |
量筒 读数/mL | 0 | 32 | 60 | 80 | 90 | 95 | 98 | 100 | 98 | 94 | 90 | 90 |
(1)实验开始,将MnO2和双氧水混合,操作方法是______。
(2)反应结束,共制得氧气______mL。
(3)列式计算双氧水中H2O2的溶质质量分数___。(保留到0.01%)
(4)根据表中数据,画出产生O2的体积随时间的变化关系____;70s后测得气体体积逐渐变小的原因是:______。

查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】有一包固体粉末,可能含有镁粉、碳粉、氧化铜、硫酸钾、氢氧化钠中的一种或几种。为探究固体的组成,某化学兴趣小组进行如图所示的实验:
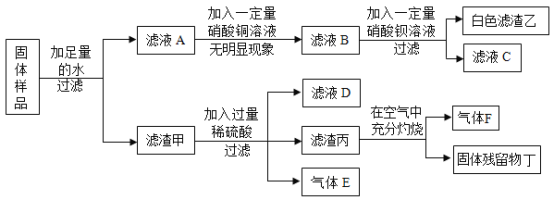
回答下列问题:
(1)实验中生成白色滤渣乙的化学方程式是__________。
(2)原固体中一定没有的物质是___________(填化学式)。
(3)实验结束后,该小组将滤液C和滤液D都倒入废液缸,有白色沉淀生成,则滤液C中一定含有的阳离子有________。(填离子符号)
(4)如果滤渣丙的质量等于固体残留物丁的质量,则气体F与固体残留物丁的质量比为_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据铁在空气中生锈的原理,实验小组设计了图示实验装置测定空气里氧气的含量。已 知广口瓶的有效容积为 242mL,实验 8 分钟后打开止水夹,水从烧杯流入广口瓶中的体积 为 48mL。下列说法不正确是
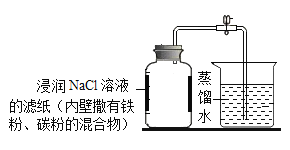
A.实验前广口瓶底部必须放入少量水B.铁生锈的主要条件是与空气和水直接接触
C.氯化钠和炭粉可能起加快铁粉生锈的作用D.本实验测得空气里氧气的体积分数约为 19.8%
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】氨气是一种无色有刺激性气味的气体,密度比空气_____,是氮肥工业的重要原料。
(1)实验室常用浓氨水和氢氧化钠固体混合制取少量氨气,产生氨气的原因有:
①氢氧化钠固体溶于水放热,促使氨水分解生成氨气,化学方程式为:_____![]() NH3↑+H2O。
NH3↑+H2O。
②氢氧化钠固体溶于水放热,使氨气在水中的_____,有利于氨气逸出。
(2)某化学兴趣小组为探究分子的运动情况,在玻璃管两端同时放入蘸有溶液的棉花,做了图1所示实验,发现在玻璃管内形成了白色烟环(成分为氯化铵)且偏向蘸有浓盐酸的棉花一端。
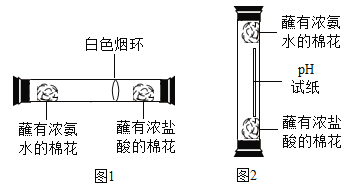
①白色烟环偏向蘸有浓盐酸的棉花一端的原因是_____;
②写出该反应的化学方程式:_____。
(3)为了获得更好的视觉效果,该小组同学设计了图2所示实验。
(实验步骤)从玻璃管顶部将蘸有浓盐酸的棉花投入底部(过程中棉花不接触管壁),pH试纸迅速变为红色;再将蘸有浓氨水的棉花固定在玻璃管顶部,用摄像机记录实验现象。
(查阅资料)图3所示是本实验所用的pH试纸的显色范围。

(现象分析)图4所示是摄像机记录下来的pH试纸每15s的显色情况。
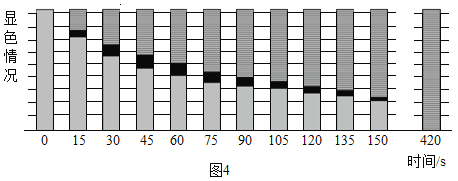
420s时,pH试纸全部变为绿色,白烟大部分沉降至量筒底部。图4中,75s时pH试纸从上至下的颜色依次为绿色、_____和_____。
(拓展探究)上述实验中,若上下棉花颠倒,即玻璃管底部是蘸有浓氨水的棉花,顶部是蘸有浓盐酸的棉花,则pH试纸几乎直接变为绿色,玻璃管内迅速充满白烟,解释产生这种现象的原因:_____。
(4)氯化铵是一种常见的氮肥。某氯化铵化肥的含氮量经测定是25.2%,已知杂质不含氮元素,则此化肥中氯化铵的质量分数为_____(计算结果保留一位小数)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】除了金、银等极少数金属外,绝大多数金属元素以化合物(即金属矿物)的形式存在于自然界。将金属矿物中的金属还原出来的过程在工业上称为金属的冶炼。利用金属活动性的不同,可以采用不同的冶炼方法。
一、热分解法:对一些非常不活泼金属,可以直接用加热分解的方法从其化合物中还原出来。例如:2HgO![]() 2Hg+O2↑;2Ag2O
2Hg+O2↑;2Ag2O![]() 4Ag+O2↑;
4Ag+O2↑;
二、电解法:对一些非常活泼的金属,采用一般的还原剂很难将它们还原出来,工业上常用电解法冶炼。例如:MgCl2(熔融)![]() Mg+Cl2↑; 2NaCl(熔融)
Mg+Cl2↑; 2NaCl(熔融)![]() 2Na+Cl2↑;
2Na+Cl2↑;
三、热还原法:大部分金属的冶炼都是通过在高温下发生的氧化还原反应来完成的,常用的还原剂有焦炭、一氧化碳、氢气等。一些活泼金属也可作还原剂,将相对不活泼的金属从其化合物中置换出来。
根据上述信息回答下列问题:
(1)不能用热分解法制得的金属是______________;
A Cu B Fe C Ag D Hg
(2)下列反应不符合工业冶炼金属实际情况的是_____________;
A2MgO![]() 2Mg+O2↑ B 4CO+Fe3O4
2Mg+O2↑ B 4CO+Fe3O4![]() 3Fe+4CO2
3Fe+4CO2
C 2Al+Fe2O3![]() Al2O3+2Fe D 2KCl(熔融)
Al2O3+2Fe D 2KCl(熔融)![]() 2K+Cl2↑
2K+Cl2↑
(3)若从铅的矿物中冶炼铅,可使用上述方法中的__________,理由是__________________。
(4)电解熔融氯化钠可以得到金属钠,但是电解食盐水不能得到金属钠,测得电解饱和食盐水后所得溶液的pH大于7,则可知电解后一定有__________生成另外还有两种气体单质生成、写出电解饱和食盐水的化学方程式__________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】二氧化硫(SO2)在通常情况下是一种无色、有刺激性气味的有毒气体,是造成酸雨的原因之一,它能与氢氧化钠溶液反应生成盐和水。实验室可用亚硫酸钠(Na2SO3)及硫酸制取二氧化硫,某实验小组的同学欲利用下列装置和药品制取二氧化硫,并对二氧化硫与水在通常情况下能否发生化学反应进行实验探究,设计的探究过程如下,请回答有关问题。

(1)A装置中分液漏斗也可用长颈漏斗代替,与长颈漏斗相比,分液漏斗的好处是_____:
(2)写一个实验室用A装置制取密度小于空气的气体化学方程式_____.
(3)I假设:二氧化硫与水在通常情况下能发生化学反应,生成物是一种酸性物质。
Ⅱ设计方案:先验证水能否使蓝色石蕊试纸变色;再验证二氧化硫气体能否使干燥的蓝色石蕊试纸变色;最后验证二氧化硫气体能否使湿润的蓝色石蕊试纸变色。
Ⅲ查阅资料:a.二氧化硫易溶于水;酸能使湿润的蓝色石蕊试纸变红;二氧化硫能被浓硫酸干燥
Ⅳ进行实验:
①请补全B装置中导管位置。_____
②实验过程中,装置C内石蕊试纸的颜色始终没有变化,这说明什么?_____
③装置D中胶头滴管中的蒸馏水在二氧化硫气体生成之前滴到蓝色石蕊试纸上,未见试纸颜色发生变化,当有二氧化硫气体通过时发现湿润的蓝色石蕊试纸变红,此现象说明什么?_____
④请写出装置E的作用_____
V结论:原假设_____(填“成立“或“不成立)。
(4)某食用碱的主要成分是碳酸钠,其中含少量氯化钠。向盛有6g食用碱的烧杯内加入足量的水,搅拌后加入过量的氯化钙,充分反应后过滤得到滤渣5.0g。请计算该食用碱中氯化钠的质量分数是多少?_____(计算结果精确至0.1%)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com