
| A. | 100毫升的量筒 | B. | 100毫升的量筒和滴管 | ||
| C. | 50毫升的量筒和滴管 | D. | 50毫升的量筒 |
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:初中化学 来源: 题型:选择题
| A. | 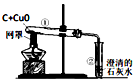 试管①红色粉末变成黑色,试管②的澄清石灰水变浑浊,说明碳具有还原性 | |
| B. |  铁丝表面覆盖红色物质,溶液由蓝色逐渐变成无色,说明铁的金属活动性强于铜 | |
| C. |  烧杯中的红色溶液逐渐变浅最后变成无色,说明盐酸与氢氧化钠能发生反应 | |
| D. | 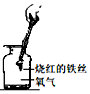 铁丝在氧气中剧烈燃烧、火星四射,生成的黑色物质是氧化铁 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | A2B | B. | A2B3 | C. | AB2 | D. | A3B2 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
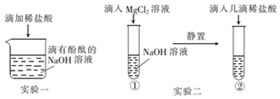 实验小组在探究“酸与碱能否发生反应”时,进行了如图所示实验.请根据实验回答:
实验小组在探究“酸与碱能否发生反应”时,进行了如图所示实验.请根据实验回答:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ①④②⑤③ | B. | ④①②⑤③ | C. | ②⑤④①③ | D. | ⑤②④③① |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
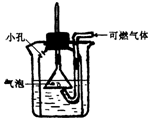 如图是某同学设计的一个可燃气体安全点燃装置,对此装置的评价和使用错误的是( )
如图是某同学设计的一个可燃气体安全点燃装置,对此装置的评价和使用错误的是( )| A. | 未经检验纯度的气体通过此装置后可安全点燃,不会发生爆炸 | |
| B. | 此装置防止点燃不纯气体爆炸的原理是使不纯的气体不与燃着气体直接接触 | |
| C. | 要达到安全点燃效果,烧杯内的水可不没过倒置漏斗的边缘 | |
| D. | 此装置适用于难溶于水的可燃性气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com