
【题目】实验室通常用澄清石灰水检验二氧化碳的存在,若二氧化碳过量,会进一步与碳酸 钙、水反应生成易溶于水的碳酸氢钙(CaCO3+H2O+CO2═Ca(HCO3)2)。若向含有 Ca(OH)2 7.4g 的澄清石灰水里缓缓通入一定量的二氧化碳,反应后若生成 5g 沉淀,则通 入二氧化碳的质量可能为( )
A.2.2gB.4.4gC.6.6gD.13.2g
科目:初中化学 来源: 题型:
【题目】甲、乙两种固体物质的溶解度曲线如图所示。下列叙述正确的是( )
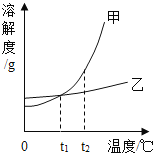
A.t1℃时,甲和乙溶液中溶质的质量分数相等
B.甲溶液中混有少量乙,可用冷却热饱和溶液法提纯甲
C.将t1℃时甲、乙饱和溶液升温至t2℃,甲溶液中溶质质量分数会比乙大
D.t2℃时,用等质量的甲和乙固体配制饱和溶液,得到甲溶液的质量大于乙
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】现欲配制70g溶质质量分数为20%的氢氧化钠溶液,该实验的部分操作如下图所示:
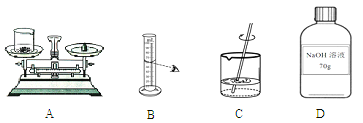
(1)需要称取氢氧化钠的质量是14g(使用了砝码和游码),若称量时出现了右盘高的现象(如图A),接下来的操作应该是___________;
A.向右移动游码 B.左盘中增加氢氧化钠 C.左盘中减少氢氧化钠
(2)若按照图B的方法量取水,会使配制的溶液质量分数______(选填“偏大”或“偏小”);
(3)D中所贴标签有一项内容不正确,请加以改正___________;
(4)若要将已配好的70g溶质质量分数为20%的氢氧化钠溶液,稀释成10%的氢氧化钠溶液,需要加水__________g。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】老师要求用规定的BaCl2溶液与适量的Na2SO4溶液制备BaSO4。完成操作Ⅰ后,小红发现自己错把Na2CO3溶液当成Na2SO4溶液,而此时BaCl2溶液已完全消耗。老师启发他,可用生成物和其他试剂完成制备BaSO4的实验。整个实验流程如图所示:

(1)试剂M是__________,气体C是__________。
(2)操作Ⅱ的名称是_________。
(3)反应①的化学方程式为________,溶液a中溶质是_______。
(4)反应③的基本反应类型为___________。
(5)从理论上讲,该实验过程最终得到的BaSO4质量与原方案得到的BaSO4质量是否相等?_________(填“是”或“否”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】碳酸镁水合物是制备镁产品的中间体。
(制取MgCO33H2O)工业上从弱碱性卤水(主要成分为MgCl2)中获取MgCO33H2O的方法如图:
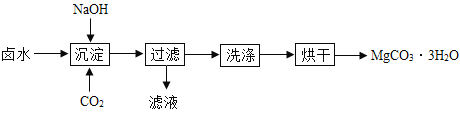
(1)沉淀过程的化学方程式为:MgCl2+CO2+2NaOH+2H2O═MgCO33H2O↓+2___。
(2)沉淀过程的pH随时间的变化如图所示,沉淀过程的操作为____(填标号)。
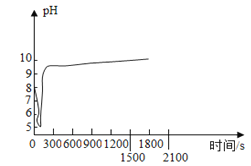
a 向卤水中滴加NaOH溶液,同时通入CO2
b 向NaOH溶液中滴加卤水,同时通入CO2
c 向卤水中通入CO2至饱和,然后滴加NaOH溶液,同时继续通入CO2
d 向NaOH溶液中通入CO2至饱和,然后滴加卤水,同时继续通入CO2
(3)沉淀过程的溶液中镁离子含量随时间的变化如图所示,不同温度下所得到沉淀产物如下表所示。
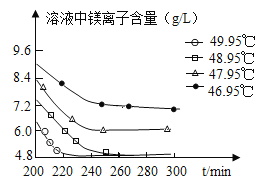
温度(℃) | 产物 |
46.95 | MgCO33H2O |
47.95 | MgCO33H2O |
48.95 | MgCO33H2O |
49.95 | Mg5(OH)2(CO3)44H2O |
则沉淀过程选择的温度为____℃,理由是此温度下,Mg2+沉淀的速率较快,沉淀效率较高,且不会生成其它沉淀。
(测定MgCO33H2O的纯度)
(查阅资料)
1.碱石灰是CaO与NaOH的固体混合物。
2.MgCO33H2O+H2SO4=MgSO4+CO2↑+4H2O。
3.Mg5(OH)2(CO3)44H2O也可以表示为Mg(OH)24MgCO34H2O,其相对分子质量为466,能与硫酸反应生成CO2。
4.Ba(OH)2能溶于水
(实验步骤)
利用如下图所示装置(图中夹持仪器略去)进行实验,以确定MgCO33H2O的纯度。
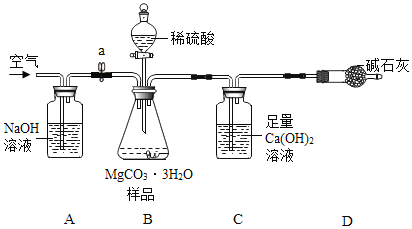
依据实验过程回答下列问题:
(1)A中NaOH溶液的作用是________。
(2)C装置中反应生成CaCO3的化学方程式为_____;D中碱石灰的作用为___。
(3)下列各项措施中,不能提高测定准确度的是____(填标号)。
a 在加入硫酸之前,应排净装置内的CO2气体
b 为了缩短实验时间,快速滴加硫酸
c 在A~B之间增添盛有浓硫酸的洗气装置
d 在C装置左侧导管末端增添多孔球泡
(4)小明认为应将C装置中澄清石灰水换成Ba(OH)2溶液,理由一:___,使CO2被吸收的更完全;理由二: BaCO3的相对分子质量比CaCO3大,等质量的MgCO33H2O生成的BaCO3质量大于CaCO
(5)实验中准确称取15.0g样品三份,进行三次测定,测得生成CaCO3沉淀的平均质量为10.0g。请计算样品中MgCO33H2O的纯度(写出计算过程)____。
(6)若获取MgCO33H2O的样品中含有少量Mg5(OH)2(CO3)44H2O,则样品中MgCO33H2O的纯度____(填“偏大”“不变”或“偏小”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】将50g稀盐酸10g大理石的烧杯中,恰好完全反应,烧杯中剩余物质的质量为57.8g(杂质不溶于水且不参加反应)求:
(1)生成CO2的质量______________;
(2)稀盐酸中溶质的质量分数__________;
(3)反应后所得溶液的质量分数__________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】同学要在实验室配制15%的氯化钠溶液50g ,该同学按下图所示步骤依次操作,请回答下列问题:
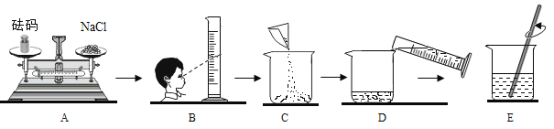
(1)量取水的体积时,需要使用的量筒规格为_________________mL(填“20或50或100”)。
(2)操作E中玻璃棒的作用是__________。
(3)按图B量取水配得的溶液溶质质量分数__________(填“偏大”、“偏小”或“不变”)。若上图A中砝码的质量5g,游码为2.5g,则称得的氯化钠质量为__________________g。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙、丙、丁四种物质在反应前后的质量关系如图所示,下列有关说法错误的是

A. 参加反应的甲和乙质量比为 12:19
B. 丙可能是该反应的催化剂
C. x 的值是 7
D. 丁可能是化合物
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在一密闭容器中加入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,测得反应前及t1、t2时各物质质量如图所示。下列说法中正确的是( )
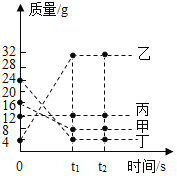
A.该反应为分解反应B.丙可能为该反应的催化剂
C.生成乙的质量为32gD.参加反应的甲、丁质量变化之比为2:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com