
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:初中化学 来源: 题型:阅读理解
| 品名:XX“暖宝宝” 成分:袋内物质:铁粉、水、活性炭、食盐、蛭石等 内袋材料:微孔透气无纺布 外袋材料:不透气塑料 用法:临时用前,打开外袋取出内袋,直接贴在衣服上.打开外袋后保持温暖12小时. |
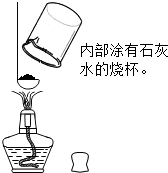 【实验一】拆开包装袋,观察袋内物质,袋内物质主要为黑色粉末,其中混有“亮黄色”固体小颗粒
【实验一】拆开包装袋,观察袋内物质,袋内物质主要为黑色粉末,其中混有“亮黄色”固体小颗粒| 操作 | 现象 | 结论 |
| 取少量被吸起来的黑色粉末加水溶解后过滤,取所得滤液置于试管中,滴加少量 硝酸银 硝酸银 溶液和稀硝酸 稀硝酸 ,(均填名称) |
① 产生白色沉淀 产生白色沉淀 ,② 白色沉淀不溶解 白色沉淀不溶解 ; |
含有氯化钠 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
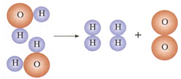 水是生命之源,人类的日常生活与工农业生产都离不开水.
水是生命之源,人类的日常生活与工农业生产都离不开水.| 通电 |
| 通电 |
| 加热 |
查看答案和解析>>
科目:初中化学 来源:三点一测丛书 九年级化学 (下) 人教版 题型:043
| |||||||
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 2CuO+H2O+CO2↑,古代人们发现翠绿的孔雀石在森林大火中会变成红色的铜,请写出转化为铜的另一个反应方程式:________
2CuO+H2O+CO2↑,古代人们发现翠绿的孔雀石在森林大火中会变成红色的铜,请写出转化为铜的另一个反应方程式:________| 金属 | Ti | Mg | Ag |
| 反应现象 | 反应缓慢 | 反应强烈 | 无明显现象 |
| 次数 | 1 | 2 | 3 | 4 |
| 加入酸质量/g | 5.0 | 5.0 | 5.0 | 5.0 |
| 剩余固态质量/g | 4.5 | 4 | 3.5 | 3.2 |
查看答案和解析>>
科目:初中化学 来源:2011-2012学年江苏省南京市建邺区中考一模化学试卷(解析版) 题型:探究题
以下是甲、乙两同学对有关镁与盐酸反应的系列研究研究一:镁与盐酸反应过程中的能量变化以及反应速率的变化:

(1)实验时需将镁条进行打磨,其目的是 。
(2) 反应中试管外壁发烫,说明镁与稀盐酸反应是 反应(填“吸热”或“放热”),化学方程式为
(3)实验测得镁片产生气体的速率(v)与时间(t)的关系如图所示,则t1~t2时间内反应速率逐渐加快的主要原因是 。

研究二.反应后所得溶液的酸碱性探究
【发现问题】
(1)反应后甲同学用pH试纸测定试管中溶液的酸碱性,发现pH小于7,说明甲同学所得溶液呈 性,(选填“酸”“碱”或“中”)。
(2)反应后乙同学的试管中镁条有剩余,向试液中滴入两滴酚酞溶液,振荡显红色,说明乙同学所得溶液呈 性。对此现象,乙同学重复如上实验,得到同样结果。
【提出猜想】
甲同学:猜想Ⅰ:稀盐酸过量,使溶液pH小于7;猜想Ⅱ:氯化镁溶液pH小于7。
乙同学:猜想Ⅰ:氯化镁溶液使酚酞变红色; 猜想Ⅱ:镁与热水反应使酚酞变红色。
【实验与思考】
为验证猜想,甲、乙两同学均需测定________溶液的酸碱性,实验表明该溶液显弱酸性。
乙同学为完成猜想Ⅱ,在滴有两滴酚酞的热水中放入一段打磨过的镁条,观察到溶液很快变为红色,同时还观察到镁条表面有气体生成,收集并点燃该气体,发现能燃烧,请根据实验现象写出镁与水反应的化学反应方程式 。
【结论】
镁与稀盐酸反应,镁反应完全后所得溶液显酸性;
镁与稀盐酸反应,镁过量时所得溶液显碱性。
【拓展与延伸】
(1)金属氯化物的水溶液可能显中性或弱酸性;与金属的活动性顺序有关,如氯化钠溶液显中性,氯化镁溶液显弱酸性,氯化钾溶液显________性。
(2)活泼金属能与水在一定条件下反应。实验发现钠与冷水剧烈反应,产生大量的气体。由此可见金属与水反应与金属的活动性顺序_______(填“有关”或“无关”)。
研究三. 金属活动性强弱与原子结构的关系
下图为镁原子、钙原子和钡离子结构示意图,据此推测,这三种金属的活动性最强的是
__________________。

【解析】研究一、
(1)依据镁的化学性质较活泼易形成氧化镁保护膜进行分析;
(2)依据反应时温度的变化分析反应时能量的问题,依据镁与盐酸反应会生成氢气及氯化镁书写方程式;
研究二、
发现问题:依据酸碱性溶液pH的大小进行分析判断;
实验思考:根据甲乙同学的不同猜想分析两人必做的实验操作,以据反应的现象结合质量守恒定律的有关应用对化学方程式进行书写即可;
拓展延伸:(1)依据题目中有关的信息对相关物质的溶液酸碱性进行判断即可;
(2)根据活泼金属与水反应的条件分析即可;
研究三、根据钠镁活动性强弱的关系分析三种金属中活动性最强的物质即可.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com