
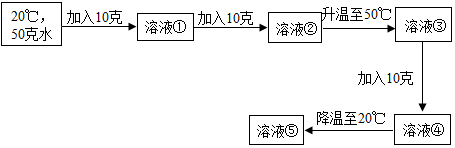
分析 根据固体的溶解度是指在一定温度下,某固体物质在100g水中达到饱和状态时所溶解的质量,根据固体物质的溶解度可以判断出在一定温度时形成的溶液是否饱和进行解答.
解答 解:由于氯化钾在20℃时的溶解度是34g,即100g水中最多溶解34g氯化钾,50g水中最多溶解17g氯化钾;因此在20℃时在50g水中加入10g氯化钾,氯化钾会全部溶解,得到的①溶液是20℃不饱和溶液;又加入10g氯化钾,由于在50g水中最多溶解17g氯化钾,因此这20g氯化钾只能溶解17g,所以形成的②溶液是20℃饱和溶液;升温至50℃,由于氯化钾在50℃时的溶解度是42.6g,50g水中最多溶解21.3g氯化钾,因此后加入的氯化钾会全部溶解,而且形成的溶液③是50℃不饱和溶液,但又加入10g氯化钾,这10g氯化钾会再溶解1.3g,形成的溶液④是50℃饱和溶液,然后降温到20℃时,有晶体析出,形成溶液⑤是20℃饱和溶液.
(1)上述实验所得溶液中,属于饱和溶液的是②④⑤;
(2)溶液①的质量=50g+10g=60g;溶液④的质量=50g+21.3g=71.3g;
(3)⑤是20℃饱和溶液,氯化钾在20℃时的溶解度是34g,即100g水中最多溶解34g氯化钾,50g水中最多溶解17g氯化钾;溶质的质量分数为$\frac{34g}{100g+34g}×100%$≈25.4%
故答案为:(1)②④⑤; (2)60;71.3; (3)25.4%
点评 解答本题关键是熟悉饱和溶液与不饱和溶液的转化,知道溶解度的四要素.


 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
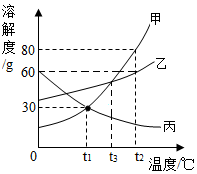
| A. | t1℃时,30g甲物质溶于70g水中得到30%的甲溶液 | |
| B. | t3℃时将甲、乙两物质的饱和溶液降温到t2℃,析出晶体质量甲>乙 | |
| C. | t2℃时,甲、丙溶液中溶质的质量分数甲>丙 | |
| D. | 将t3℃时甲、乙、丙三种物质的饱和溶液降温到t1℃,所得溶液溶质的质量分数关系是乙>甲>丙 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 1g物质完全燃烧 | ||
| 产生二氧化碳的质量/g | 放出的热量/kJ | |
| 甲烷 | 2.75 | 56 |
| 煤碳 | 3.67 | 32 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 金属 | 镁 | 铝 | 铝镁合金 |
| 熔点/℃ | 649 | 660 | 463 |
| 硬度 | 2.0 | 2.75 | 3-4 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题

| A. | t2℃时,甲、乙、丙三种物质的溶解度由大到小的顺序是甲>乙>丙 | |
| B. | t2℃时,将50g甲物质放入100g水中充分溶解得到甲的饱和溶液 | |
| C. | 将t2℃时,三种物质的饱和溶液降温 至t1℃,所得溶液的溶质质量分数关 系是乙>甲=丙 | |
| D. | 将丙的饱和溶液变为不饱和溶液,可采用降温的方法 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
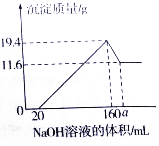 已知:Mg(OH)2是难溶性碱,不溶于碱性溶液;A1(OH)3也是难溶性碱,但它既可以与强酸反应,生成可溶性铝盐,也可以与强碱反应,生成可溶性偏铝酸盐,例如Al(OH)3+NaOH=NaAlO2(偏铝酸钠)+2H2O.现将一定质量的镁铝合金样品全部溶于100mL某浓度的盐酸溶液中,之后向所得溶液中滴加200g/L的NaOH溶液,生成沉淀质量与加入的NaOH溶液体积关系如图所示.
已知:Mg(OH)2是难溶性碱,不溶于碱性溶液;A1(OH)3也是难溶性碱,但它既可以与强酸反应,生成可溶性铝盐,也可以与强碱反应,生成可溶性偏铝酸盐,例如Al(OH)3+NaOH=NaAlO2(偏铝酸钠)+2H2O.现将一定质量的镁铝合金样品全部溶于100mL某浓度的盐酸溶液中,之后向所得溶液中滴加200g/L的NaOH溶液,生成沉淀质量与加入的NaOH溶液体积关系如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com