
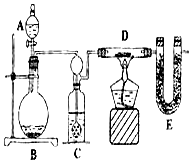
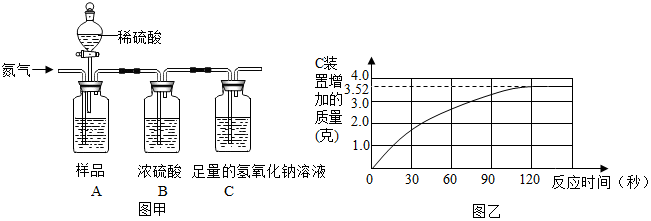
 某同学为了测定水中氢、氧两元素的质量比,设计了以下实验,实验装置如图.
某同学为了测定水中氢、氧两元素的质量比,设计了以下实验,实验装置如图.分析 (1)根据化学方程式书写方法写出方程式即可;(2)多孔球泡增大了气体与溶液的接触面积考虑本题;(3)先通氢气再加热,使水蒸气汽化即可;(4)根据D装置质量的减少量就是氧化铜中氧元素的质量,即水中氧元素质量;E装置质量的增加量就是生成的水的质量,用水的质量减去氧元素的质量就是氢元素质量,再计算原子个数比即可;(5)根据碱石灰能吸收水分和二氧化碳考虑;(6)实验测得m(H):m(O)>1:8,说明E装置质量增加的多分析.
解答 解:(1)反应物是氢气和氧化铜,生成物是铜和水,反应条件是加热,所以方程式是:H2+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O;
(2)装置C中进气管出口为多孔球泡,多孔球泡除导气外,其主要作用是增大气体与溶液的接触面积,使气体充分被干燥;
(3)先通氢气再加热,使水蒸气汽化全部进入E装置;
(4)D装置质量的减少量就是氧化铜中氧元素的质量,即水中氧元素质量:W1-W3;E装置质量的增加量就是生成的水的质量:W4-W2,用水的质量减去氧元素的质量就是氢元素质量:W4-W2-(W1-W3)=W4+W3-W2-W1,元素的质量除以该元素的相对原子质量就是该元素的原子个数;水中氢原子与氧原子的个数比的算式为:$\frac{{W}_{1}-{W}_{3}}{16}:\frac{{W}_{4}+{W}_{3}-{W}_{2}-{W}_{1}}{1}$;
(5)碱石灰能吸收水分和二氧化碳,所以在装置E后再接一个盛有碱石灰的U形管,此U形管的作用是防止空气中的水蒸气和二氧化碳进入E管,减小实验误差;
(6)A.装置C中硫酸的浓度不大,作用不太好,所以氢气中的水蒸气没有被吸收完全,所以E装置质量增加的多,故A能导致m(H):m(O)>1:8;
B.装置E后缺少干燥装置,空气中的水蒸气会进入E装置,故B能导致m(H):m(O)>1:8;
C.称量装置D和装置E的质量时,称量值均偏大,差值可能不变,故C不能导致m(H):m(O)>1:8;
D.CuO没有全部被还原,导致D装置质量减少的少了,即氧元素质量少了,故D能导致m(H):m(O)>1:8.
故选C.
故答案为:(1)H2+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O;(2)增大气体与溶液的接触面积,使气体充分被干燥;(3)先通氢气再加热,使水蒸气汽化全部进入E装置;(4)$\frac{{W}_{1}-{W}_{3}}{16}:\frac{{W}_{4}+{W}_{3}-{W}_{2}-{W}_{1}}{1}$;(5)防止空气中的水蒸气和二氧化碳进入E管,减小实验误差;(6)C.
点评 本题考查学生的分析能力、实验能力和计算能力,注意把握实验原理、实验技能以及物质性质的分析,题目难度中等.


科目:初中化学 来源: 题型:计算题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
 如图是某试剂瓶标签的部分内容.请回答下列问题:
如图是某试剂瓶标签的部分内容.请回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:计算题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. |  | B. | 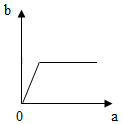 | C. |  | D. | 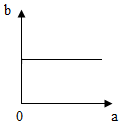 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
 实验室有一瓶未开封的浓盐酸,部分标签如图所示.
实验室有一瓶未开封的浓盐酸,部分标签如图所示.查看答案和解析>>
科目:初中化学 来源: 题型:多选题
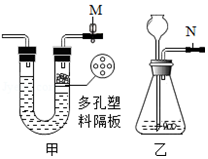
| A. | 此时甲装置中的止水夹M处于关闭状态 | |
| B. | 甲装置气体导出过程中容器内外气压相等 | |
| C. | 甲装置具有控制反应进行与否的功能 | |
| D. | 乙装置N处添加止水夹可以与甲装置具有相同功能 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
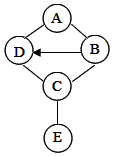 图中A、B、C、D、E是初中化学常见的五种不同类别的物质,A是产量最大的一种金属,E是导致温室效应的一种气体,图中“--”表示相连物质能发生化学反应,“→”表示两种物质间的转化关系(部分反应物、生成物及反应条件省略).
图中A、B、C、D、E是初中化学常见的五种不同类别的物质,A是产量最大的一种金属,E是导致温室效应的一种气体,图中“--”表示相连物质能发生化学反应,“→”表示两种物质间的转化关系(部分反应物、生成物及反应条件省略).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com