
| | 实验一 | 实验二 | 实验三 |
| 实验方案 |  |  |  |
| 实验现象 | 铬片表面产生气泡缓慢,溶液变蓝色 | 无明显现象 | 铝片表面产生气泡较快 |
| 结论 | 铬能与稀硫酸发生反应,反应速率较慢 | 铜不与稀硫酸反应 | 铝能与稀硫酸发生反应,反应速率较快 |
| 三种金属在金属活动性顺序中的相对位置关系是 | |||


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案科目:初中化学 来源:不详 题型:实验题

 离子,加入下列沉淀剂的顺序是(填序号) 。
离子,加入下列沉淀剂的顺序是(填序号) 。查看答案和解析>>
科目:初中化学 来源:不详 题型:推断题
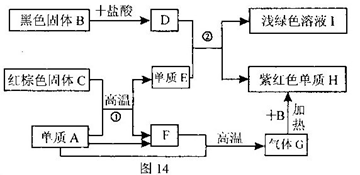
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
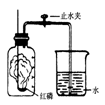
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
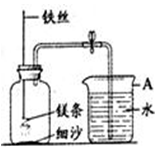
查看答案和解析>>
科目:初中化学 来源:不详 题型:单选题

查看答案和解析>>
科目:初中化学 来源:不详 题型:问答题
| 实验步骤及操作 | 可能出现的实验现象 | 实验结论 |
| 取试样于试管中,加入足量的蒸馏水并振荡 ①吸取上层清液于pH试纸上 ②倒去上层清液,再向试管中注入稀盐酸 | ①pH>7 ② | 部分变质 |
| ①pH=7 ② | | |
| ① ②没有气体产生 | |
查看答案和解析>>
科目:初中化学 来源:不详 题型:填空题
| | Fe3O4 | Fe2O3 | 铁 |
| 分解温度/℃ | 1538 | 1400 | — |
| 熔点/℃ | — | — | 1535 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:问答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com