某同学为测定一瓶失去标签的氢氧化钠溶液的溶质质量分数,取80g该氢氧化钠溶液,逐滴加入10%的稀硫酸至pH等于7,测得反应后溶液的总质量为129g.计算:
(1)该氢氧化钠溶液的质量分数;
(2)实验室若配制500g10%的稀硫酸,需要98%的浓硫酸(密度为1.84g/cm3)多少毫升?(结果精确到0.1).
解:(1)解:参加反应H
2SO
4的质量:(129g-80g)×10%=4.9g
设参加反应NaOH的质量为x.
2NaOH+H
2SO
4=Na
2SO
4+2H
2O
80 98
x 4.9g
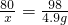
x=4g
氢氧化钠溶液的质量分数=
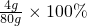
=5%
(2)设需要浓硫酸的体积为y.
y×1.84 g/cm
3×98%=500g×10%
y=27.7cm
3=27.7mL
答:氢氧化钠溶液中溶质的质量分数为5%;配制500g 10%的稀硫酸,需要98%的浓硫酸27.7 mL.
分析:(1)根据质量守恒定律,在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和.所以参与反应的稀硫酸的质量=反应后溶液的总质量-氢氧化钠溶液的质量,据此列出比例式,就可计算出氢氧化钠溶液中所含的氢氧化钠质量以及生成硫酸钠的质量,然后根据溶质质量分数的计算公式计算即可.
(2)依据溶液稀释前后溶质的质量不变分析解答;
点评:本题主要考查学生运用化学方程式和溶质质量分数公式综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.解题的关键是分析反应物与生成物之间的质量关系.

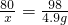
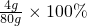 =5%
=5%

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案