
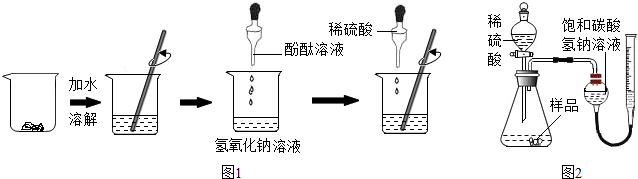
分析 (1)根据指示剂的变色规律分析,酚酞遇酸性和中性溶液都不变色,遇碱性溶液变红;
(2)根据玻璃棒搅拌的作用分析;
(3)当溶液颜色又恰好变为无色时,说明酸能与碱恰好发生反应;
(4)碳酸钠与硫酸反应生成硫酸钠、水和二氧化碳,
(5)根据二氧化碳可以溶于水,与水反应分析;
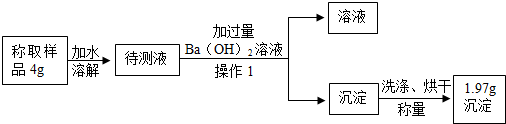
(6)过滤可将固体与液体分开,加入Ba(OH)2溶液除去剩余的碳酸钠,
(7)氢氧化钡与碳酸钠反应生成碳酸钡和氢氧化钠,根据碳酸钡的质量和方程式分析;
(8)如果沉淀不洗涤就直接烘干、称量,碳酸钡粘附有氢氧化钠等
解答 解:(1)氢氧化钠溶液显碱性,使酚酞变红色;
(2)边滴加稀硫酸,边要用玻璃棒不断搅拌的目的是使稀硫酸与氢氧化钠成分混合,发生反应;
(3)当溶液颜色又恰好变为无色时,说明酸能与碱恰好发生反应,此时溶液的pH=7;
(4)碳酸钠与硫酸反应生成硫酸钠、水和二氧化碳,化学方程式为:Na2CO3+H2SO4=Na2SO4+H2O+CO2↑;
(5)二氧化碳可以溶于水,与水反应,造成所测气体的体积偏小;
(6)经过操作1后得到了沉淀和滤液,所以操作1的名称是:过滤,足量的氢氧化钡可以将碳酸钠充分的沉淀,所以在加入过量氢氧化钡的目的是:充分除尽溶液中的碳酸钠.
(7)氢氧化钡与碳酸钠反应生成碳酸钡和氢氧化钠,所以1.97g的白色沉淀是碳酸钡;
设碳酸钠的质量分数为x
Na2CO3+Ba(OH)2=BaCO3↓+2NaOH
106 197
x×4g 1.97g
$\frac{106}{197}=\frac{x×4g}{1.97g}$
x=26.5%
(8)如果沉淀不洗涤就直接烘干、称量,碳酸钡粘附有氢氧化钠等,造成沉淀质量变大,计算出碳酸钠的质量分数偏高.
故答案为(1)溶液变红色;碱;
(2)使稀硫酸与氢氧化钠成分混合,发生反应;
(3)=7;
(4)Na2CO3+H2SO4=Na2SO4+H2O+CO2↑;
(5)二氧化碳可以溶于水,与水反应;
(6)过滤;充分除尽溶液中的碳酸钠;
(7)碳酸钡;26.5%
(8)偏高.
点评 本考点属于物质的分离和提纯,利用流程图中的现象和实验方案的设计,考查同学们的判断能力,同学们只要认真分析,根据条件综合把握,问题就会迎刃而解.


 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:初中化学 来源: 题型:选择题
 某校科学课外活动小组从实验室药品柜中发现了一瓶无色溶液,但这瓶试剂的标签已残缺无法辨认,只知道这是一种实验室常用的试剂,根据图中标签提供的信息,请你猜想一下这瓶溶液中的溶质可能是酸、碱、盐、氧化物的哪一种( )
某校科学课外活动小组从实验室药品柜中发现了一瓶无色溶液,但这瓶试剂的标签已残缺无法辨认,只知道这是一种实验室常用的试剂,根据图中标签提供的信息,请你猜想一下这瓶溶液中的溶质可能是酸、碱、盐、氧化物的哪一种( )| A. | 酸 | B. | 碱 | C. | 盐 | D. | 氧化物 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 0.4 mol NH3 | B. | 4℃时5.4 mL水 | ||
| C. | 10 g氖气 | D. | 6.02×1023个硫酸分子 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
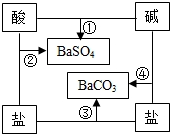 如图是常见酸、碱、盐之间的相互转化关系.
如图是常见酸、碱、盐之间的相互转化关系.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com