
| A. | Fe3O4、Fe2O3、FeO、FeS2 | B. | FeO、Fe2O3、Fe3O4、FeS2 | ||
| C. | FeO、Fe3O4、Fe2O3、FeS2 | D. | Fe2O3、Fe3O4、FeO、FeS2 |
分析 根据铁的化合物的化学式,通过变形使铁的原子个数相等,然后比较化合物中其它元素的原子的相对原子质量之和,其它原子的相对原子质量之和越大的,在该化合物中铁元素的质量分数就越小.
解答 解;FeO、Fe2O3、Fe3O4、FeS2,将铁原子的个数变为1个,分别变形为FeO、Fe${O}_{\frac{4}{3}}$,Fe${O}_{\frac{3}{2}}$,FeS2,硫原子的相对原子质量为32,是氧原子相对原子质量的2倍,可看作是4个氧原子;4>$\frac{3}{2}$>$\frac{4}{3}$>1,其它原子的相对原子质量之和越小的,在该化合物中铁元素的质量分数就越大,则铁元素的质量分数由大到小排列为FeO>Fe3O4>Fe2O3>FeS2.
故选C.
点评 本题难度不大,考查化学式的有关计算,将化学式进行变形,使铁原子个数化为相等是正确快速解答的关键.


科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 黄白色 黄白色 | B. | 黄白色 蓝色 | C. | 蓝色 蓝色 | D. | 蓝色 黄白色 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
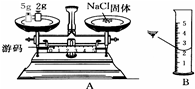 实验室欲配制30g质量分数为25%的NaCl溶液,有下列操作:a.用量筒量取水,b.用天平称取所需氯化钠,c.所需食盐与水混合后搅拌溶解,d.计算所需食盐和水的质量,e.溶液的转存并贴标签.试回答下列问题.
实验室欲配制30g质量分数为25%的NaCl溶液,有下列操作:a.用量筒量取水,b.用天平称取所需氯化钠,c.所需食盐与水混合后搅拌溶解,d.计算所需食盐和水的质量,e.溶液的转存并贴标签.试回答下列问题.查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验步骤 | 实验现象 | 解释与结论 |
| 分别取三支试管,向其中入 等质量、等浓度的稀硫酸然 后将铝、铬、铜三种金属分 别插入三支试管中. | 铝片表面产生的气泡较快; 铬片表面产生气泡较缓慢, 溶液变蓝色; 铜片无明显现象. | 猜想二成立. 铬与稀硫酸反应生成蓝色的 硫酸亚铬(CrSO4)溶液,该反应的化学方程式为Cr+H2SO4=CrSO4+H2↑. |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
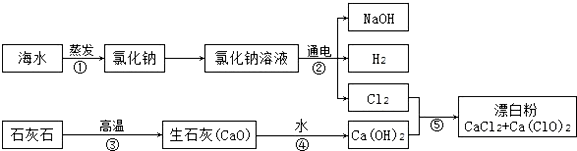
| 实验操作 | 实验现象 | 实验结论 |
| 取少量样品于试管中,滴加足量的稀盐酸. | 有气体产生,气体使石灰水变浑浊. | 猜想2成立 |
| 在上述反应后的试管中加少量品红溶液. | 红色变浅或消失. |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 根据所学化学知识填空:
根据所学化学知识填空:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com