
| 实验步骤 | 现象 | 结论 |
| 该废液中一定没有盐酸 | ||
| 该废液中一定含有Na2CO3 |
科目:初中化学 来源: 题型:选择题
| A. | 红磷在空气中燃烧,产生大量白烟 | |
| B. | 向氢氧化钠溶液中滴入硫酸铜溶液生成蓝色沉淀 | |
| C. | 将红热的细铁丝放在氧气中,剧烈燃烧,火星四射,生成氧化铁黑色固体 | |
| D. | 硫在氧气中燃烧时,产生蓝紫色火焰,生成有刺激性气味的气体 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 用稀硝酸除去NaCl中的Na2CO3杂质 | |
| B. | 用水区分硝酸铵和氢氧化钠 | |
| C. | 用加熟石灰,研磨的方法鉴别尿素和硫酸铵 | |
| D. | 用点燃闻气味的方法鉴别羊毛纤维和合成纤维 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 反应中MnO2是催化剂 | B. | 该反应属于置换反应 | ||
| C. | 反应需要通电才能进行 | D. | 反应中化学能转化成电能 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
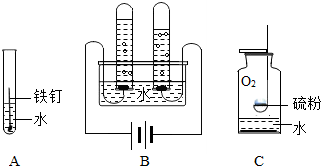
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 第1次 | 第3次 | 第4次 | |
| 加入盐酸的质量(g) | 20 | 20 | 20 |
| 剩余固体的质量(g) | 35 | a | 20 |

查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验 | 试管1 | 试管2 | 试管3 |
| 实验操作 | 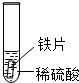 | 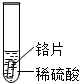 |  |
| 实验现象 | 铁片表面产生气泡较慢,溶液变为浅绿色 | 铬片表面产生气泡较快,溶液变为蓝色 | 无明显现象 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com