解:①纯碱(Na
2CO
3)水溶液呈碱性,pH大于7;
故答案为:大于;
【思考与交流】根据反应的化学方程式Na
2CO
3+Ca(OH)
2═CaCO
3↓+2NaOH,反应生成碳酸钙沉淀和氢氧化钠,氢氧化钠溶解在反应后的溶液中,因此所得滤液中一定含有生成的氢氧化钠;氢氧化钠溶液呈碱性,能使无色酚酞变成红色;
故答案为:NaOH;红;
【讨论与交流】小肖同学认为:可能还有Na
2CO
3和Ca(OH)
2,这显然出反应Na
2CO
3+Ca(OH)
2═CaCO
3↓+2NaOH相矛盾,既然两物质可以发生反应就不会同时产生剩余;
故答案为:小肖;Na
2CO
3和Ca(OH)
2能发生反应,两种物质不可能同时存在;
【活动与探究】⑥根据碳酸钠能与氯化钙反应生成碳酸钙沉淀和氯化钠,因此,加入的氯化钙溶液可观察到出现白色沉淀;
故答案为:有白色沉淀产生;
⑦根据碳酸钠能与稀硫酸反应生成硫酸钠、水和二氧化碳,加入稀硫酸时,会出现溶液中有大量气泡产生;
故答案为:溶液中有大量气泡产生;
【探索与拓展】设碳酸钠的质量为x,反应生成硫酸钠的质量为y
Na
2CO
3+H
2SO
4═Na
2SO
4+H
2O+CO
2↑
106 142 44
x y 8.8g
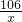
=
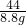
x=21.2g
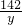
=
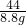
y=28.4g
原混合物中Na
2CO
3的质量分数=
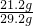
×100%=72.6%
样品混合物中氢氧化钠的质量=29.2g-21.2g=8g,
设8g氢氧化钠与稀硫酸反应生成硫酸钠的质量为z
2NaOH+H
2SO
4═Na
2SO
4+H
2O
80 142
8g z
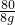
=
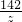
z=14.2g
A点所示溶液中溶质的质量分数=
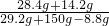
×100%=25%
答:(1)原混合物中Na
2CO
3的质量分数72.6%;(2)A点所示溶液中溶质的质量分数25%.
分析:①纯碱(Na
2CO
3)虽然属于盐类物质,但其水溶液呈碱性;溶液的pH与溶液酸碱性关系为:pH>7,溶液呈碱性,pH=7,溶液呈中性,pH<7,溶液呈酸性;
【思考与交流】根据反应的化学方程式Na
2CO
3+Ca(OH)
2═CaCO
3↓+2NaOH,反应生成碳酸钙沉淀和氢氧化钠,因此所得滤液中一定含有生成的氢氧化钠;氢氧化钠溶液呈碱性,酚酞遇碱性溶液变成红色;
【讨论与交流】由Na
2CO
3+Ca(OH)
2═CaCO
3↓+2NaOH,因此,碳酸钠与氢氧化钙不可能同时出现剩余,因此它们还可以继续发生反应;
【活动与探究】根据碳酸钠的性质可知,碳酸钠可与氯化钙反应生成碳酸钙沉淀和氯化钠,可与稀硫酸反应放出二氧化碳气体,因此,加入氯化钙溶液可观察到产生白色沉淀,加入稀硫酸可观察到有大量气泡产生;
【探索与拓展】(1)由产生气体的质量与所加稀硫酸质量的关系图可知,反应放出二氧化碳的质量为8.8g,根据反应的化学方程式,由产生二氧化碳的质量计算样品中碳酸钠的质量,碳酸钠质量与样品质量比可计算出原混合物中Na
2CO
3的质量分数;
(2)恰好完全反应A点所示溶液为硫酸钠溶液,其中溶质硫酸钠由样品中氢氧化钠、碳酸钠分别与稀硫酸反应生成的硫酸钠,分别根据反应的化学由碳酸钠、氢氧化钠质量计算生成硫酸钠的质量;利用质量守恒定律,计算出恰好完全反应时所得溶液的质量;最后使用溶质质量分数定义式计算所得溶液中溶质的质量分数
点评:曲线的折点表示反应放出气体达到最大值,即此时恰好完全反应;根据质量守恒定律,此时所得溶液质量=样品质量+所加稀硫酸质量-放出气体质量.

 纯碱(Na2CO3)水溶液的pH ①______ (填“大于”“小于”或“等于“)7.某活动小组的同学准备利用氢氧化钙、纯碱制得烧碱(NaOH),反应的化学方程式为Na2CO3+Ca(OH)2═CaCO3↓+2NaOH,他们将这两种物质的溶液混合后过滤,得滤渣和滤液,对滤液中溶质的成分进行探究:
纯碱(Na2CO3)水溶液的pH ①______ (填“大于”“小于”或“等于“)7.某活动小组的同学准备利用氢氧化钙、纯碱制得烧碱(NaOH),反应的化学方程式为Na2CO3+Ca(OH)2═CaCO3↓+2NaOH,他们将这两种物质的溶液混合后过滤,得滤渣和滤液,对滤液中溶质的成分进行探究: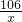 =
=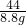 x=21.2g
x=21.2g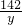 =
=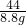 y=28.4g
y=28.4g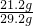 ×100%=72.6%
×100%=72.6%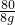 =
=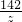 z=14.2g
z=14.2g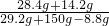 ×100%=25%
×100%=25%

