
根据下列实验装置图回答问题:
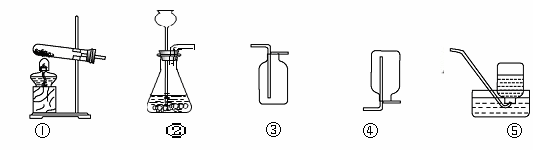
(1)实验室用高锰酸钾制氧气的化学方程式为_____________________________。选用的发生装置是 (填字母序号,下同)。
(2)实验室制取二氧化碳时,选用的收集装置是 。验证二氧化碳收集满的方法是
(写出方法、现象、结论)
(3)实验室收集某气体只能用装置④,由此说明该气体具有的物理性质是
科目:初中化学 来源: 题型:
下表列出了一定温度和压强下,一定质量的活性炭所能吸附常见气体的体积,分析表中数据与气体组成、性质的关系,你认为下列结论正确的是( )
| 气体 | H2 | N2 | O2 | CO2 | Cl2 |
| 气体的沸点/℃ | -252 | -196 | -183 | -78 | -34 |
| 被吸附体积/mL | 4.5 | 11 | 35 | 97 | 494 |
A.气体的沸点越低,越易被吸附
B.气体分子所含原子个数越多,越易被吸附
C.气体是化合物时,易被吸附
D.气体的相对分子质量越大,越易被吸附
查看答案和解析>>
科目:初中化学 来源: 题型:
重金属盐可使人中毒,当人误食重金属盐时,可以喝大量牛奶、鸡蛋清或豆浆解毒。原因是上述物质中含有较多的蛋白质,蛋白质可以和重金属盐形成不溶于水的化合物,可以减少重金属盐类对胃肠粘膜的危害,起到缓解毒性的作用,为了验证蛋白质与重金属盐类反应,形成难溶于水的化合物,我们可以做如下实验:
在一支试管中加入3 mL鸡蛋清溶液,再加少量的乙酸铅溶液,然后把试管中的物质倒入盛有清水的小烧杯中观察现象并回答问题:
(1)小烧杯中出现的现象
。
(2)为什么在农业上可以用硫酸铜配制的波尔多液来消灭害虫?
查看答案和解析>>
科目:初中化学 来源: 题型:
(1)用图I装置测定空气中氧气的含量,证明空气中氧气的体积分数约为1/5, a, b两
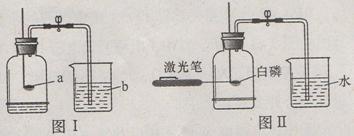 种物质可选用(填序号)。
种物质可选用(填序号)。
A.红磷、水
B.木炭、水
C.硫、NaOH溶液
D.小蜡烛、NaCl溶液
思敏同学对该实验进行反思后,提出了改进方法(如图II所示),你认为改进后的优点是(任写两点) 。
(2)“炭火烧烤”是许多同学喜爱的食物,其原理是利用木炭燃烧的高温来烤熟食物,炭燃烧反应的化学方程式是。冬天,在门窗紧闭的房间里吃“烧烤”,容易发生的危险是。如果在红热的木炭上撤一些氧化铁红棕色粉末,可能发生反应的化学方程式是 。
(3)冬季,园林工人在树干上涂石灰浆以保护树木免受虫害。某化学兴趣小组的同学
欲对工人用剩的石灰浆进行探究。
【提出猜想】石灰浆中除水之外的物质是什么?
I.只有Ca(OH)2; II.只有 ;III. 。
【实验验证】①要证明石灰浆中含有Ca(OH)2,可采取的操作及现象是。
②取石灰浆少量,盛装在试管中,如果向其中加入,观察到,则证明猜想II或III正确。
【思维拓展】工业上用石灰浆与Cl2反应制漂白粉,用来杀菌消毒。
① 配平下列化学方程式:Cl,+Ca(OH)=CaCl2+Ca(ClO)2+H,0
② 百度得知,漂白粉杀菌消毒的原理是:其中的Ca(CIO)2能与某些酸反应,生成的HCIO具有强氧化性,且不与CaCO3反应。写出CO2通人漂白粉溶液中发生反应的化学方程
式: 。
查看答案和解析>>
科目:初中化学 来源: 题型:
为探究气体X的组成,某兴趣小组进行图所示实验(固定装置未画出)。
【资料在线】
(1)加热条件下,气体X能与氧化铜反应生成铜、水和氮气。
(2)碱 石灰为固体氢氧化钠和氧
石灰为固体氢氧化钠和氧 化钙的混合物,不与气体X反应。无水氯化钙可吸收气体X。
化钙的混合物,不与气体X反应。无水氯化钙可吸收气体X。
(3)本实验条件下,氮气密度为1.15g·L-1,装置内空气中的水与二氧化碳对相关数据测定的影响可忽略不计。
【实验步骤】
(1)连接仪器,并检查装置气密性。
(2)取一定量氧化铜,准确称得其质量为2.40g。
(3)按图所示装入药品,测量并记录相关数据Ⅰ(见表)。
(4)连接A、B、C装置, 将气体X缓缓通入一段时间后,连接上D装置,读数后开始加热。当A装置中氧化铜反应完全,停止加热,继续通入气体X至玻璃管冷却,再次测量并记录相关数据Ⅱ(见表)。
【实验装置】

【相关数据】
| 测量项目 数据编号 | I | II |
| 玻璃管(含药品)的质量/g | 52.40 | 51.92 |
| B装置(含药品)的质量/g | 102.00 | 102.54 |
| 氮气的体积/mL | 243.5 |
【回答问题】
⑴B装置中氧化钙吸水的原理为 (用化学方程式表示)。
⑵实验过程中,当观察到 ,说明氧化铜已反应完全,停止加热,继续通入气体X至玻璃管冷却的目的是 。
⑶分析 实验测量的数据,生成水的质量为 g,氧化铜中氧元素的质量为 g。由此推知,气体X中一定 (填“有”或 “没有”)氧元素。
实验测量的数据,生成水的质量为 g,氧化铜中氧元素的质量为 g。由此推知,气体X中一定 (填“有”或 “没有”)氧元素。
⑷通过计算推导出气体X的化学式。
查看答案和解析>>
科目:初中化学 来源: 题型:
某校学习小组准备探究气体的测定和数据处理方法
【提出问题】
如何利用石灰石(主要成分为CaCO3)与稀盐酸反应来测定生成的CO2的质量和体积,并处理数据。
【实验设计】
通过下列两个实验分别测定CO2的质量和体积:

【分析与表达】
(1)上述两个实验中,反应的化学方程式是_______________________。
(2)实验Ⅰ中,将小烧杯中的所有稀盐酸分几次加入到大烧杯中,并不断搅拌,判断石灰石中CaCO3完全反应的实验现象是___________________________________________。
(3)实验Ⅱ中,先连接好装置,再_______(填操作名称),然后装好药品,最后将10 mL稀盐酸快速推入到烧瓶中,若稀盐酸是缓慢推入的,则可能造成的后果是______。
【记录与处理】
(4)已知实验Ⅰ反应前的总质量[m(大烧杯+石灰石粉末)+m(小烧杯+稀硫酸)],要计算生成的CO2的质量,至少还需要的数据是_______(填序号)
A.m(小烧杯) B.m(大烧杯) C.m(大烧杯+反应后的剩余物)
(5)实验Ⅱ的实验记录如下(表中数据在相同温度、相同压强条件下测定)
| 时间/min | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 注射器读数/mL | 60.0 | 85.0 | 88.0 | 89.0 | 89.5 | 89.8 | 89.9 | 90.0 | 90.0 | 90.0 |
①  根据以上实验过程和数据综合分析,最终生成CO2
根据以上实验过程和数据综合分析,最终生成CO2
的体积是______mL,理由是____________。
②根据你的认识,在坐标图中绘制出0~10min生成
CO2体积随时间变化的曲线。
【反思与评价】
(1)经过分析,你认为实验Ⅰ的优点是________,实验Ⅱ
的优点是________。
查看答案和解析>>
科目:初中化学 来源: 题型:
氢氧化钙固体是登山运动员常用的能源提供剂。某探究小组的同学通过查阅资料得知,氢化钙(CaH2)遇水反应生成氢氧化钙和氢气。
探究小组的同学把一定量的CaH2加入Na2CO3溶液中,充分反应后过滤,得到滤渣和滤液。经检验滤渣的成分是碳酸钙。
【提出问题】滤液中溶质的成分是什么?
【猜想与暇设】猜想一:NaOH 猜想二:NaOH、Ca(OH)2
猜想三:NaOH、 Na2CO3 猜想四:NaOH、 Na2CO3、Ca(OH) 2
经过讨论,大家一致认为猜想四不台理,请用化学方程式说明原因_______________。
【实验验证】
| 实验 | 现象 | 结论 |
| 实验一:取滤液,向其中滴入少量碳酸钠溶液 | 无明显显现 | 猜想__不成立 |
| 实验二:另取滤液,向其中加入足量稀盐酸 | ____________ | 猜想三成立 |
【反思与拓展】
①若向NH4Cl的溶液中加一定量的CaH2,充分反应,产生的气体是____________________。
②登山运动员常用CaH2作为能源提供剂,与氢气相比,其优点是_______________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
根据下图回答问题

(1)写出图中标号①的仪器名称___________;
(2)实验室用锌粒和稀硫酸制取并收集较为纯净的氢气,所用装置是_______________(填序号,下同),反应的化学方应方程式是_____________________________。
(3)已知铜和浓硝酸反应能制取二氧化氮气体,二氧化氮是一种红棕色的气体,密度大于空气。
①制取二氧化氮气体选用的发生装置是____________,向试管中装入铜片的正确操作是______________________。
②用图中F装置演示分子运动的实验时,为缩短演示时间,二氧化氮最好放在_______(填上或下)瓶的集气瓶中,抽取两瓶间的玻璃片,可以看到的现象是___________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
世界上每年因锈蚀而报废的金属设备和材料,高达产量的20%~40%.某实验小组对铁的燃烧和锈蚀进行如下探究。
探究一:铁丝燃烧
 如图1所示,取3根粗细、长度均相同的光亮细铁丝,将其中两根分别盘成螺旋状,在每根铁丝一端系上粗铜丝,另一端系一根火柴杆,点燃火柴杆待快燃尽时,分别插入充满氧气的集气瓶中。观察到:1、Ⅱ中铁丝都剧烈燃烧,且Ⅱ中铁丝燃烧比I中的更剧烈;Ⅲ中铁丝没有燃烧。
如图1所示,取3根粗细、长度均相同的光亮细铁丝,将其中两根分别盘成螺旋状,在每根铁丝一端系上粗铜丝,另一端系一根火柴杆,点燃火柴杆待快燃尽时,分别插入充满氧气的集气瓶中。观察到:1、Ⅱ中铁丝都剧烈燃烧,且Ⅱ中铁丝燃烧比I中的更剧烈;Ⅲ中铁丝没有燃烧。

(1) 集气瓶中加入少量水的作用:
(2) 为什么Ⅲ中铁丝不能燃烧
(3) 分析Ⅱ中铁丝燃烧比I中更剧烈的原因
探究二:铁粉腐蚀的条件
如图2所示,将包有样品的滤纸包用大头针固定在橡胶塞上,迅速塞紧,观察到量筒内水沿着细导管慢慢进入广口瓶(容积为l46ml)。当温度恢复至室温,量筒内水面高度不变时读数(此广口瓶内氧气含量几乎为零).记录量筒的起始和最终读数以及所需时间如下表:
| 序号 | 样品 | 量筒起始读数/ml | 量筒最终读数/ml | 所需时间/min |
|
| 1.0g铁粉、0.2g碳和10滴水 | 100 | 72 | 约120 |
|
| 1.0g铁粉、0.2g碳和10滴水和少量NaCl | 100 | 72 | 约70 |
| ③ |
|
|
(4)金属腐蚀的过程实际就是金属元素化合价 (填升高或降低)的过程
(5)实验①和②说明NaCl 可以 (填“加快”或“减慢”)铁锈蚀的过程。
(6)实验开始后,广口瓶温度上升说明铁锈蚀是 (填“放热”或“吸热”)过程。
(7)实验①和③是探究碳对铁锈蚀速率的影响,实验③表格空白处样品的组成是 。
(8)该装置还可能用于测量空气中氧气的含量。根据上述数据计算出空气中氧气的体积分数是 %(精确到小数点后1位),试分析该实验结果出现误差的原因 (写任意一条即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com