
科目:初中化学 来源: 题型:阅读理解
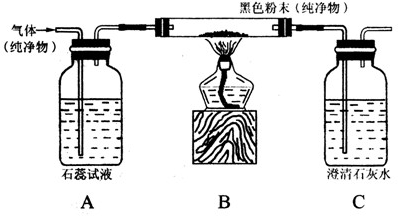
 某研究性学习小组设计并进行了如下实验.
某研究性学习小组设计并进行了如下实验.
| ||
| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
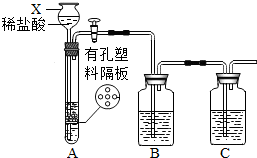
| ||
| ||
查看答案和解析>>
科目:初中化学 来源:江苏省扬州中学教育集团树人学校2012年中考第二次模拟考试化学试题 题型:058
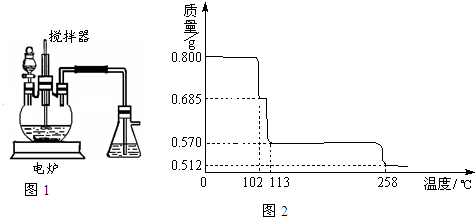
胆矾(CuSO4·5H2O)是重要的化工原料,工业上用Cu与浓H2SO4、浓HNO3反应制备该物质,采取间歇加热、逐渐加入浓HNO3的方法来制备CuSO4·5H2O的新工艺.模拟制备装置如下图所示,根据题意回答下列问题.

(1)如图装置中,分液漏斗内装的液体是________(填“浓硝酸”或“浓硫酸”),该发应会产生有毒气体NO、NO2等,锥形瓶中液体可以吸收该气体,反应原理为:NO+NO2+2NaOH![]() 2NaNO2(该物质化学名是________)+H2O.该装置中搅拌器的作用是________.反应所得产品在________(填“三颈烧瓶”或“锥形瓶”)中.
2NaNO2(该物质化学名是________)+H2O.该装置中搅拌器的作用是________.反应所得产品在________(填“三颈烧瓶”或“锥形瓶”)中.
(2)如果铜粉、硫酸及硝酸都比较纯净,则制得的CuSO4·5H2O中常常含有的杂质是一种硝酸盐,其化学式是________,已知10℃、20℃时有关物质的溶解度为:CuSO4·5H2O(17.4 g、20.7 g);该硝酸盐(95.3 g、125.1 g),提纯CuSO4·5H2O的实验操作是________.
(3)用无水硫酸铜检验某双氧水中是否含水时,除了发现固体变蓝外,还发现该双氧水中有气泡产生,对此现象你的猜想是________,检验该气体的实验操作是________.
(4)将0.80 g CuSO4·5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示.

①由图中可以看出,CuSO4·5H2O分解的最低温度是________.
②试通过计算确定238℃时固体物质的化学式.(要计算过程)
③将CuSO4·5H2O固体加热到570℃分解后,得到的主要产物是黑色粉末、硫的最高价氧化物和水蒸气,该反应的化学方程式为________.
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源:2012年江苏省扬州中学教育集团树人学校中考化学二模试卷(解析版) 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com