


| 实验操作 | 主要实验现象 | 结论 |
| ① 取溶液X适量于试管中,加入过量CaCl2溶液 取溶液X适量于试管中,加入过量CaCl2溶液 取①中反应后上层清液适量,加入适量稀盐酸 取①中反应后上层清液适量,加入适量稀盐酸 取①中反应后上层清液适量,加入酚酞试液 取①中反应后上层清液适量,加入酚酞试液 |
出现白色沉淀 出现白色沉淀 无气泡 无气泡 不变色 不变色 |
证明溶液中只有Na2CO3 |
| 实验操作 | 主要实验现象 |
| 取溶液X适量于试管中,加入过量CaCl2溶液 | 出现白色沉淀 |
| 取①中反应后上层清液适量,加入适量稀盐酸 | 无气泡 |
| 取①中反应后上层清液适量,加入酚酞试液 | 不变色 |


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:初中化学 来源: 题型:阅读理解
| 实验操作 | 主要实验现象 | 结论 |
| ①取样,滴加 CaCl2 CaCl2 溶液 |
出现白色沉淀 出现白色沉淀 |
证明溶液中有Na2CO3 |
| ②取上层清液,滴加 Ca(OH)2 Ca(OH)2 溶液 |
无白色沉淀产生 | 证明溶液中无NaHCO3 |
| ③取样, 加入过量氯化钙溶液,充分反应后滴加酚酞试剂 加入过量氯化钙溶液,充分反应后滴加酚酞试剂 |
不变色 不变色 |
证明溶液中无NaOH |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
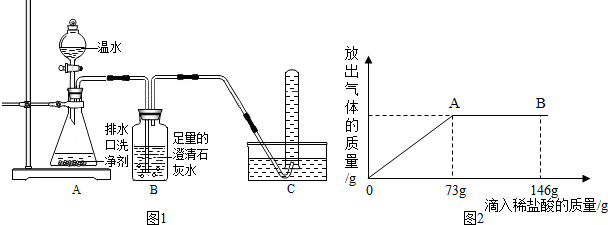
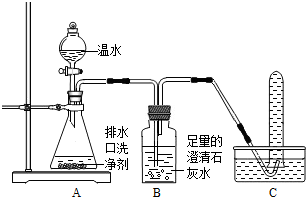
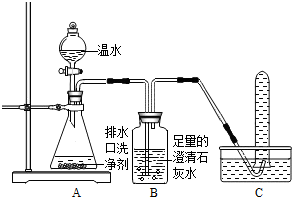 (2013?潍城区二模)小强同学看到妈妈将买来的排水口洗净剂(主要成分:过碳酸钠、柠檬酸)洒在厨房排水口网状盖的底部,倒上温水后迅速冒出气泡.为了解其反应过程,他与学习小组的同学进行了如下探究.
(2013?潍城区二模)小强同学看到妈妈将买来的排水口洗净剂(主要成分:过碳酸钠、柠檬酸)洒在厨房排水口网状盖的底部,倒上温水后迅速冒出气泡.为了解其反应过程,他与学习小组的同学进行了如下探究.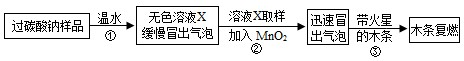
| 实验操作 | 主要实验现象 | 结论 |
| ① | 证明溶液中有Na2CO3 | |
| ② | 证明溶液中无NaHCO3 | |
| ③ | 证明溶液中无NaOH |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
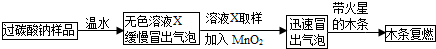
| 实验步骤 | 实验现象 | 实验结论 |
| a.取上述无色液体X少量于 试管中,至不再冒气泡为止, 加入足量的氯化钙溶液. |
产生白色沉淀 | 无色溶液X中含有 Na2CO3 Na2CO3 |
| b.取步骤a所得上层清液少量,滴加 稀盐酸 稀盐酸 |
没有气泡产生 没有气泡产生 |
无色溶液X中不含 NaHCO3 NaHCO3 |
查看答案和解析>>
科目:初中化学 来源:2013届山东省诸城市树一中学九年级第三次学情检测化学试卷(带解析) 题型:探究题
小强同学看到妈妈将买来的排水口洗净剂(主要成分:过碳酸钠、柠檬酸)洒在厨房排水口网状盖的底部,倒上温水后迅速冒出气泡。为了解其反应过程,他与学习小组的同学进行了如下探究。
【探究一】小组同学根据所学的化学知识设计并进行了如图所示的实验。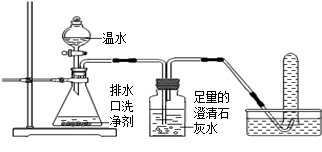
A B C
实验中观察到如下现象:A中有气泡产生;B中的澄清石灰水变浑浊;C中收集到的气体能使燃着的木条燃烧更旺。由此同学们得出结论:生成的两种气体分别是: (填化学式)。B中有关反应的化学方程式是 。
【探究二】
(1)实验过程:
教师提供了一瓶过碳酸钠(Na2CO4),小组同学进行了如下实验探究: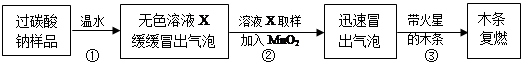
(2)提出问题:无色溶液X中的溶质有哪些物质?
(3)猜想与假设: 根据以上实验现象,X溶液中一定存在的溶质是 ;还可能存在Na2CO3、NaHCO3、NaOH中的一种或几种。
(4)查找资料:
资料1:氯化钙溶液呈中性;氯化钙溶液与碳酸氢钠溶液混合不发生反应;
氯化钙溶液与碳酸钠溶液混合后发生如下反应:Na2CO3 + CaCl2 ═ CaCO3↓ + 2NaCl。
资料2:NaHCO3溶液呈碱性,与石灰水反应生成白色沉淀;碳酸氢钠、碳酸钠与足量的酸反应产物相同。
(5)实验过程:小组同学对溶液X中的溶质进行了如下实验。请将下列实验方案填写完整。
| 实验操作 | 主要实验现象 | 结论 |
| ① | | 证明溶液中有Na2CO3 |
| ② | | 证明溶液中无NaHCO3 |
| ③ | | 证明溶液中无NaOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com