
| 实验步骤 | 实验现象 | 实现结论 |
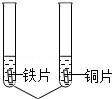 相同浓度的NiSO4 | 铁片表面有固体析出,铜片表面 . | 三种金属活动性由强到弱的顺序为 . |


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:初中化学 来源:不详 题型:实验题
查看答案和解析>>
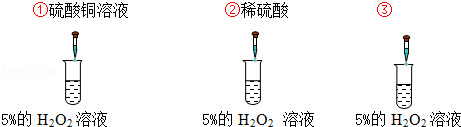
科目:初中化学 来源:不详 题型:实验题
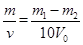 克/毫升.
克/毫升.查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
| 编号 | 实验内容与操作 | 实验现象 | 分析与结论 |
| (1) | 分别向盛有NaOH溶液、KOH溶液的A,B两试管中加入CuSO4溶液 | 两支试管均有 沉淀生成 | 不同的碱溶液都含有 (填化学符号)所以不同的碱都有相似的化学性质 |
| (2) | 用玻璃棒分别蘸取稀 和浓 于白纸A,B上,片刻. | 白纸A没明显现象;白纸B变黑(生成了炭) | 同种酸,由于 不同,它们性质不完全相同 |
| 实验内容与操作 | 实验现象 | 结论 |
| | | |
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
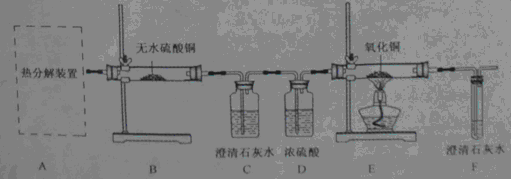

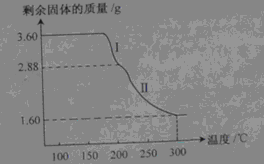
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
| | NaHCO3 | Na2CO3 |
| 加入稀盐酸 | 现象Ⅰ | 产生气泡 |
| 加入饱和石灰水 | 溶液变浑浊 | 现象Ⅱ |
| 加入CaCl2溶液 | 无明显现象 | 溶液变浑浊 |
| 加热溶液至沸腾,将气体通入澄清石灰水 | 澄清石灰水变浑浊 | 澄清石灰水无明显变化 |
| 实验步骤 | 实验现象 | |
| ①取少量样品溶于水,加入过量的CaCl2溶液。 | ; | 该反应的方程式: 。 |
| ②将上述反应后的混合液过滤,取滤液 。 | ; | 证明猜想②成立。 |
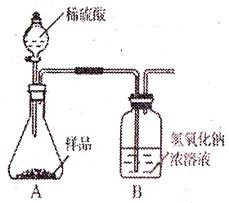 ① ;
① ;
查看答案和解析>>
科目:初中化学 来源:不详 题型:填空题


查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
| 实验 | 操作步骤 | 现象 | 结论 |
| 1 | 切开蜡烛,取出打火石,用砂纸打磨 | 打火石是银白色 | |
| 2 | | | 该金属一定不是铁 |
| 3 | 取少量打磨后的打火石于试管中,滴加硫酸铜溶液。 | 有红色物质析出 | 该金属一定是镁 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com