考点:有机物与无机物的区别,证明碳酸盐,二氧化碳的化学性质,二氧化碳对环境的影响,溶液的酸碱性测定,碳单质的物理性质及用途,碳的化学性质,反应类型的判定,书写化学方程式、文字表达式、电离方程式,化石燃料及其综合利用,几种常用的灭火器
专题:碳单质与含碳化合物的性质与用途
分析:(1)根据有机物的定义和物质的组成分析回答;
(2)根据化石燃料的种类、成分及减少二氧化碳排放的措施分析回答.
(3)根据碳海绵的特点分析判断;
(4)根据灭火的原理和二氧化碳的性质分析判断;
(5)①分析步骤1发生的反应,写出反应的化学方程式;
②根据碳酸钙与盐酸的反应分析回答;
③根据上述反应的特点分析判断;
④根据CO2和H2在一定条件下可合成甲酸(HCOOH)的反应及甲酸的性质分析判断.
(6)①根据碳、二氧化碳以及一氧化碳的转化分析;
②根据反应的特点分析反应的类型;
③根据镁与二氧化碳的反应写出反应的方程式.
解答:解:(1)乙醇是含碳的化合物,属于有机物;碳酸钙和二氧化碳虽然含有碳元素,具有无机化合物的特点,常把它们看做无机物.
(2)化石燃料主要包括煤、石油和天然气,他们都含有碳元素,其中天然气的主要成分是甲烷,化学式是:CH
4.含碳物质的燃烧会导致过多的二氧化碳排放,加剧了“温室效应”,减少二氧化碳排放的措施有很多例如:节约用纸、不使用一次性筷子等.
(3)由于碳海绵具有多孔结构,弹性好,具有吸附性;它对石油有很强的吸附能力,将吸入的石油挤出后仍可恢复原状,可处理海上石油泄漏,并且可重复利用.
(4)液态二氧化碳灭火器可用于扑救档案资料室发生的火灾,是由于二氧化碳可覆盖在燃烧物表面,隔绝空气从而达到灭火的目的,同时具有二氧化碳气化后不会污染档案资料的特点;着火点是可燃物的属性,一般不能改变.
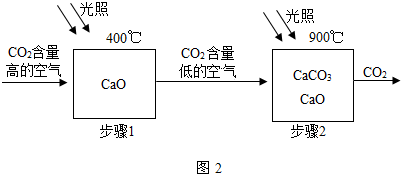
(5)①由题意可知,步骤1发生的反应是在400°C时,二氧化碳与氧化钙反应生成了碳酸钙,反应的化学方程式是:CaO+CO
2CaCO
3;
②由于碳酸钙与盐酸的反应生成了二氧化碳气体.为判断碳酸钙是否完全分解,可取少量固体于试管中,滴加过量稀盐酸溶液,若观察到试管内有气泡,则分解不完全.
③根据上述反应的特点可知,碳酸钙高温分解生成了氧化钙,氧化钙与二氧化碳反应又生成了碳酸钙,在上述反应中原料易得且可循环利用,且充分利用太阳能.由于夜间没有太阳能,不能全天候使用
④一分子的CO
2和一分子的H
2在一定条件下可合成一分子的甲酸(HCOOH),因此此反应中CO
2与H
2的分子个数比为1:1;酸性物质能够使紫色的石蕊试液变成红色,不能使酚酞试液变色,用pH试纸测定的pH会<7;
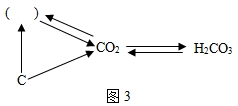
(6)①碳充分燃烧生成二氧化碳,不充分燃烧生成一氧化碳,一氧化碳燃烧能生成二氧化碳,所以,括号内一种含有碳元素物质的化学式是CO;
②由H
2CO
3→CO
2的反应可知,是由一种物质生成了两种物质,属于分解反应;
③由题意可知,CO
2常用于灭火,但镁着火不能用 CO
2灭火,原因是它们能发生反应生成另一种氧化物和单质.根据质量守恒定律可知,氧化物是氧化镁,单质是碳.反应的方程式是:2Mg+CO
22MgO+C.
故答为:(1)B;(2)石油 CH
4.节约用纸;(3)A、B、C;(4)A、B;(5)①CaO+CO
2CaCO
3;②盐酸;有气泡产生;③ab;④1:1;bc;(6)①CO ②分解 ③2Mg+CO
22MgO+C.
点评:本题内容丰富,涉及的知识点较多,但难度不大.掌握常见的碳的单质、碳以及其化合物的转化、化学方程式的书写方法等是解答本题的关键.




 阅读快车系列答案
阅读快车系列答案 已知金属铝具有自我保护能力,这是因为铝会在其表面产生一层致密的氧化膜(主要成分为氧化铝).家庭使用的铝壶底部会产生一层水垢(主要成分为碳酸钙和氢氧化镁).某同学用稀盐酸长时间浸泡以除去水垢,结果铝壶底部也被腐蚀.请写出该过程发生反应的化学方程式.
已知金属铝具有自我保护能力,这是因为铝会在其表面产生一层致密的氧化膜(主要成分为氧化铝).家庭使用的铝壶底部会产生一层水垢(主要成分为碳酸钙和氢氧化镁).某同学用稀盐酸长时间浸泡以除去水垢,结果铝壶底部也被腐蚀.请写出该过程发生反应的化学方程式.