
| 实验步骤 | 实验现象 | 实验结论 |
 | a、b中均有气泡产生,b中产生气泡的速度比a快(或b中气球膨胀的速度比a快) | 其它条件下相同时,温度越高,反应速率越快.反应的化学方程式为Zn+H2SO4=ZnSO4+H2↑ |
分析 (1)根据金属的活动性来分析;
(2)根据实验的结论来分析所能观察到的实验现象,根据化学反应的原理来书写化学方程式.
解答 解:(1)①在金属活动顺序中,镁排在铁的前面,这说明镁比铁活泼,所以镁在空气中就能够剧烈燃烧,铁丝在氧气中才能够剧烈燃烧,故填:镁比铁活泼;
(3)因为其它条件下相同时,温度越高,反应速率越快,所以当取10mL稀硫酸,均分为两等份,分别放入试管中,各加入大小相同的锌粒,再分别放入盛有20℃和80℃水的烧杯中,塞紧带有气球的瓶塞,会观察到a、b中均有气泡产生,b中产生气泡的速度比a快(或b中气球膨胀的速度比a快);锌与硫酸反应生成硫酸锌和氢气;故填:实验现象:a、b中均有气泡产生,b中产生气泡的速度比a快(或b中气球膨胀的速度比a快);实验结论:Zn+H2SO4=ZnSO4+H2↑.
点评 本题通过实验探究了影响化学反应速率的因素,难度不大.


科目:初中化学 来源: 题型:多选题
| A. | 用试管给液体加热时,液体量不超过试管容积的$\frac{1}{3}$ | |
| B. | 用试管给液体加热时,试管夹夹在离管口约$\frac{1}{3}$处 | |
| C. | 空气中氧气约占总体积的$\frac{1}{3}$ | |
| D. | 用蒸发皿给液体加热时,液体量不超过蒸发皿容积的$\frac{1}{3}$ |
查看答案和解析>>
科目:初中化学 来源: 题型:多选题
| A. | 这种气体与氧气都可以用排水法收集 | |
| B. | 这种气体与氧气都可以用向上排空气法收集 | |
| C. | 这种气体与氧气可以用相同的气体发生装置来制取 | |
| D. | 收集这种气体的方法不可以用来收集氧气 | |
| E. | 制取这种气体的发生装置不可以用来制取氧气 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 氧气在空气中的体积分数为78% | |
| B. | 液态氧可用作火箭的助燃剂 | |
| C. | 硫在氧气中燃烧发出黄色火焰 | |
| D. | 鱼类能在水中生存,证明氧气易溶于水 |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
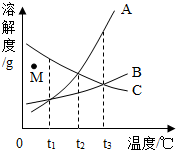 如图为A、B、C三种固体物质的溶解度曲线图(A、B、C析出晶体时均不含结晶水),根据曲线图所示,下列说法正确的是( )
如图为A、B、C三种固体物质的溶解度曲线图(A、B、C析出晶体时均不含结晶水),根据曲线图所示,下列说法正确的是( )| A. | t2℃时,溶解度最大的物质是A | |
| B. | 若将M点处C的不饱和溶液变为饱和溶液,可以选择的方法是降低温度 | |
| C. | t2℃时,将等质量的A、B、C的饱和溶液都升温到t3℃,溶液中溶剂质量的大小关系是(忽略水的挥发)B>A=C | |
| D. | t1℃时,将A、B、C三种固体物质分别溶于水所得溶液的溶质质量分数C>A=B |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验 序号 | H2O2溶液的溶质质量分数% | H2O2溶液的体积/mL | 温度/℃ | MnO2的用量/g | 收集O2的体积/mL | 反应 时间 |
| ① | 5 | 1 | 20 | 0.1 | 4 | 16s |
| ② | 15 | 1 | 20 | 0.1 | 4 | 6s |
| ③ | 30 | 5 | 35 | 0 | 4 | 98min |
| ④ | 30 | 5 | 55 | 0 | 4 | 2 0min |
| MnO2的状态 | 操作情况 | 观察结果 |
| 粉末状 | 混合不振荡 | 剧烈反应,带火星的木条复燃 |
| 块状 | 反应较慢,火星红亮但木条未复燃 |

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 肉眼能直接观察到分子机器 | |
| B. | 分子机器驱动过程中,发生了化学变化 | |
| C. | 分子机器的驱动不需要能量 | |
| D. | 分子机器“发动机”驱动方式与普通发动机相同 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com