
分析 本题考查化学用语的意义及书写,解题关键是分清化学用语所表达的对象是分子、原子、离子还是化合价,才能在化学符号前或其它位置加上适当的计量数来完整地表达其意义,并能根据物质化学式的书写规则正确书写物质的化学式,才能熟练准确的解答此类题目.
解答 解:(1)地壳中含量最多的元素是氧元素,其符号为:O;
(2)铝制品表面的氧化膜是氧化铝,其化学式为:Al2O3;
(3)胃酸中的酸是盐酸,其化学式为:HCl;
(4)离子的表示方法:在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.故镁离子可表示为:Mg2+;
故答案为:(1)O;(2)Al2O3;(3)HCl;(4)Mg2+;
点评 本题主要考查学生对化学用语的书写和理解能力,题目设计既包含对化学符号意义的了解,又考查了学生对化学符号的书写,考查全面,注重基础,题目难度较易.


 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:初中化学 来源: 题型:多选题
| A. | 金属中除少数很不活泼的金属只以单质形式存在外,其余都以化合物的形式存在 | |
| B. | 地热能、风能、生物质能、水能、太阳能都是清洁的新能源 | |
| C. | 水资源中,陆地淡水约占全球淡水储量的2.53% | |
| D. | 空气是重要的自然资源,利用其成分可生产化肥、炼钢、化工产品等 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 玻璃态水不属于氧化物 | |
| B. | 玻璃态水分子不运动 | |
| C. | 玻璃态水和普通水的化学性质相同 | |
| D. | 玻璃态水分子间隔比普通水的分子间隔小 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 将垃圾分类回收利用 | B. | 远离烟草、拒绝毒品 | ||
| C. | 改进燃煤技术,减少SO2与粉尘排放 | D. | 将工厂废液直接排入江河 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
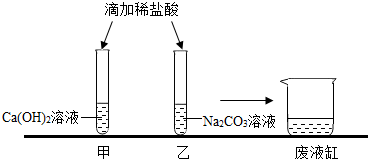 甲、乙同学在学完酸的化学性质后,做了如图的实验:
甲、乙同学在学完酸的化学性质后,做了如图的实验:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com