
| A. | 将50.0mL酒精与50.0mL蒸馏水混合,所得溶液体积小于100.0mL | |
| B. | 用托盘天平称取5.62 g 氯化钠固体 | |
| C. | 石蜡在氧气中燃烧时,有水和二氧化碳生成 | |
| D. | 硫在空气中燃烧发出明亮蓝紫色火焰,生成无色无味气体 |
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题

 所示,该元素符号为Br.与Br化学性质相似的是Cl.
所示,该元素符号为Br.与Br化学性质相似的是Cl.查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 物质名称 | 三氧化硫 | 液氨 | 水银 | 食盐水 |
| 类别 | BCD | ①CD; | ②AD | ③E |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
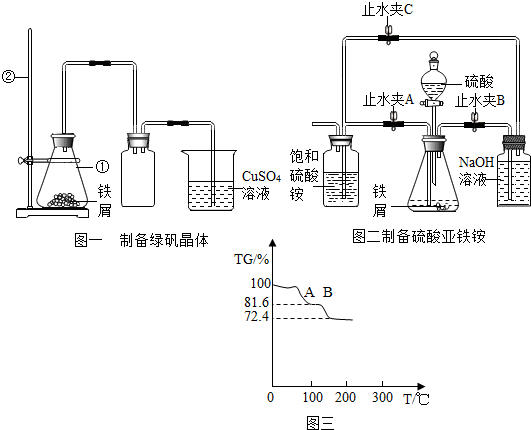
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com