
某品牌纯碱中含有少量氯化钠.某化学探究小组为了测定该纯碱的纯度(即碳酸钠的质量分数),组内一同学设计了如下实验:
【设计实验方案】
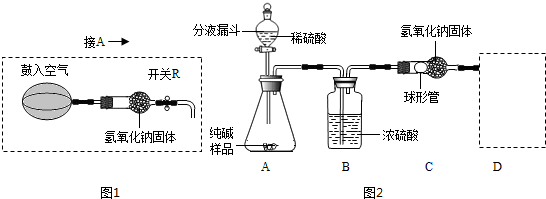
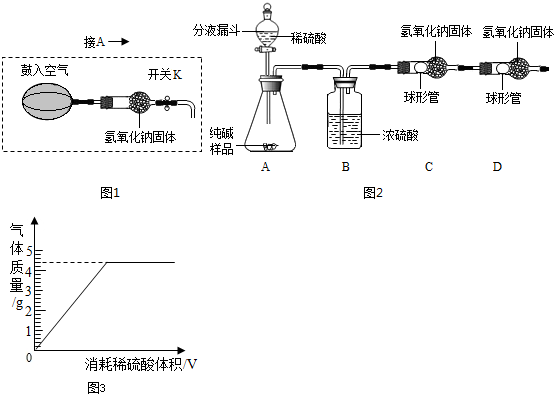
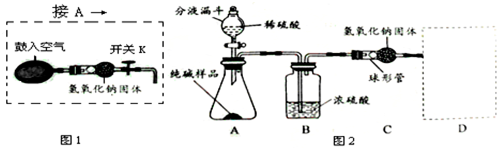
实验装置(如图2所示,固定装置略去);
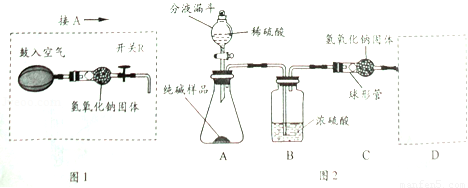
需要测定的实验数据:纯碱样品的质量;实验前、后装置(包括氢氧化钠固体)的总质量.
(1)A装置中反应的化学方程式为 ;为了保证纯碱样品中的碳酸钠完全反应,其操作是 .
(2)B装置的作用是 ;C装置中反应的化学方程式为 .
(3)补充D装置 (简要叙述或画出装置示意图).
【交流与表达】
(4)有同学认为图2所示实验装置会造成测得纯碱的纯度偏低,原因是 .
(5)为了克服图2装置的不足,有同学提出,还应增加图1装置与A装置连接(A装置中原双孔橡胶塞换成三孔橡胶塞),在反应前、后用图1装置分两次缓缓鼓入足量空气.
①反应前,断开B、C装置之间的连接,用图1装置鼓入空气的作用是 ;
②反应后,用图1装置鼓入空气的作用是 ;
③在A装置中的反应发生时,开关R处于关闭状态,其原因是 .
【数据处理】
(6)称得的纯碱样品质量为10.8g,实验前、后C装置的总质量分别为75.2g和79.6g,纯碱的纯度为 %(计算结果保留小数点后一位).
【反思与评价】
(7)能否用稀盐酸代替稀硫酸?同学们经过讨论认为不能,理由是 .
(8)改进后的实验装置能减少测定的误差,原因是①反应生成的CO2尽可能被C装置吸收;② .
(1)Na2CO3+H2SO4═Na2SO4+H2O+CO2↑;逐滴滴入稀硫酸至不再产生气泡为止;(2)除去水蒸气;2NaOH+CO2═Na2CO3+H20;(3)装氢氧化钠固体的球形管;(4)AB装置中残留反应产生的二氧化碳气体未被C中的氢氧化钠吸收;(5)①用不含二氧化碳的空气排出AB装置中原有的空气;②用不含二氧化碳的空气排出残留在AB装置中反应产生的二氧化碳气体;③避免图1装置吸收反应产生的部分二氧化碳气体;(6)98.1%;(7)稀盐酸会发出氯化氢气体,被C装置吸收,影响实验测定;
(8)避免AB装置中原来空气中二氧化碳气体对实验的干扰.
【解析】(1)反应物是Na2CO3和H2SO4生成物是Na2SO4、H2O和CO2用观察法配平,二氧化碳后面标上上升符号;因为该反应有气泡产生,没有气泡产生了,说明反应完了;
(2)浓硫酸具有吸水性,所以主要是除去二氧化碳中的水蒸气;C装置中反应的反应物是NaOH和CO2生成物是Na2CO3和H20,用观察法配平;
(3)D装置是防止空气中的水、二氧化碳进入C装置造成误差,所以用装氢氧化钠固体的球形管就能达到目的;
(4)反应结束后在AB装置中会残留反应生成的二氧化碳气体未被C中的氢氧化钠吸收,导致二氧化碳质量减少,结果会偏小;
(5)①鼓入的空气经过了氢氧化钠,已经把空气中二氧化碳除去,用不含二氧化碳的空气排出AB装置中原有的空气,由于原有的空气中含有二氧化碳;
②用不含二氧化碳的空气排出残留在AB装置中反应产生的二氧化碳气体,使反应产生的二氧化碳全部被C装置吸收;
③如果不处于关闭状态,生成的二氧化碳会进入图1被图1中氢氧化钠吸收;
(6)C装置质量的增加量就是生成二氧化碳的质量,所以生成二氧化碳的质量为:79.6g﹣75.2g=4.4g,设要生成4.4g二氧化碳需要碳酸钠质量为X则:
Na2CO3+H2SO4═Na2SO4+H2O+CO2↑
106 44
X 4.4g
根据: 解得X=10.6g,纯碱的纯度为
解得X=10.6g,纯碱的纯度为 ×100%=98.1%;
×100%=98.1%;
(7)稀盐酸会发出氯化氢气体,被C装置吸收,影响实验测定;
(8)改进后装置的优点有:反应生成的CO2尽可能被C装置吸收;避免AB装置中原来空气中二氧化碳气体对实验的干扰.


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:初中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:初中化学 来源: 题型:
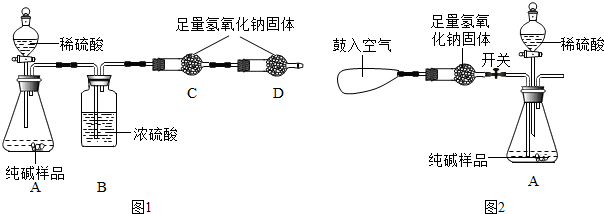
 (2013?闵行区二模)某品牌纯碱中含有少量氯化钠.化学探究小组为了测定该纯碱的纯度(即碳酸钠的质量分数),利用右图装置进行实验测定.
(2013?闵行区二模)某品牌纯碱中含有少量氯化钠.化学探究小组为了测定该纯碱的纯度(即碳酸钠的质量分数),利用右图装置进行实验测定.| 称量项目 | 称量时间 | 质量/g |
| 试样 | 11.0 | |
| 装置+稀盐酸 | 160.0 | |
| 装置+稀盐酸+试样 | 反应开始后20s | 167.0 |
| 装置+稀盐酸+试样 | 反应开始后30s | 166.6 |
| 装置+稀盐酸+试样 | 反应开始后90s | 166.6 |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com