
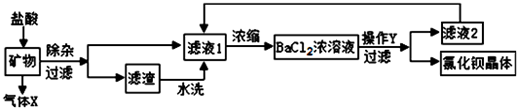
分析 根据物质相互反应的速度影响因素考虑;碳酸钠能与氯化钡反应生成碳酸钡沉淀和氯化钠;根据滤液2中含有的物质考虑;根据反应的化学方程式解答即可.
解答 解:(1)增大反应物的接触面积,可以加快反应速度,所以毒重石要进行粉碎的目的是加快反应速度;碳酸钡和盐酸反应生成的气体X是二氧化碳;
(2)检验滤渣是否洗净的试剂若是用碳酸钠溶液,则反应是氯化钡和碳酸钠反应生成碳酸钡沉淀和氯化钠;
(3)滤液2是由氯化钡浓溶液通过结晶过滤得到的,所以滤液2中含有水、氯化钡;
(4)生成二氧化碳的质量为:40g+169.4g-200.6g=8.8g
设碳酸钡的质量为x,生成氯化钡的质量为y,则有:
BaCO3+2HCl═BaCl2+H2O+CO2↑
197 208 44
x y 8.8g
$\frac{197}{x}=\frac{208}{y}=\frac{44}{8.8g}$
x=39.4g,y=41.6g
所得溶液中氯化钡的质量分数为:$\frac{41.6g}{200.6g-(40g-39.4g)}×100%$=20.8%
故答案为:(1)增加接触面积或充分反应或加快反应速率;CO2;
(2)BaCl2+Na2CO3═BaCO3↓+2NaCl;
(3)BaCl2;
(4)8.8g,20.8%
点评 本题考查的是常见的物质的制备以及根据化学方程式的计算,完成此题,可以依据已有的知识进行.


 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:初中化学 来源: 题型:解答题
 某化学兴趣小组对金属的性质做了如下探究,请你填写空格:
某化学兴趣小组对金属的性质做了如下探究,请你填写空格:查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
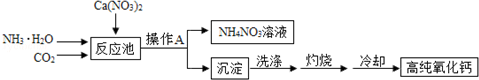
| A. | 反应池中的化学方程式为:CO2+2NH3•H2O+Ca(NO3)2═2NH4NO3+CaCO3↓ | |
| B. | 操作A为蒸发结晶 | |
| C. | 该工艺流程中可以循环使用的物质是CO2 | |
| D. | 冷却需在干燥的环境中进行,否则制得的高纯氧化钙中会混有杂质Ca(OH)2 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
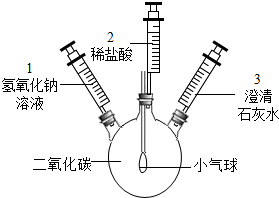 许多化学反应都伴随着明显的现象.但也有一些观察不到明显现象.某化学小组的同学探究二氧化碳与氢氧化钠反应的现象,设计了如下实验方案,请根据要求回答下列问题:
许多化学反应都伴随着明显的现象.但也有一些观察不到明显现象.某化学小组的同学探究二氧化碳与氢氧化钠反应的现象,设计了如下实验方案,请根据要求回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
 自热米饭是一种快餐食品.请根据图及表信息,回答下列问题:
自热米饭是一种快餐食品.请根据图及表信息,回答下列问题:| 营养素 | 每份含量 |
| 油脂 | 23.5g |
| 糖类 | 104.7g |
| 维生素 | 3.5g |
| 钠 | 814mg |
| 钙 | 130mg |
| 水 | 小于210g |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com