
| 实验操作 | 测定结果 | 白色固体成分 |
| 用pH试纸测定反应后溶液的酸碱度,操作方法是 | pH>7 | |
| | CaCl2 |
| 部分物质的溶解性表(室温) | ||||
| | OH- | Cl- | SO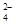 | CO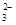 |
| H+ | | 溶、挥 | 溶 | 溶、挥 |
| Ba2+ | 溶 | 溶 | 不溶 | 不溶 |
| Ca2+ | 微溶 | 溶 | 微溶 | 不溶 |
| Mg2+ | 不溶 | 溶 | 溶 | 微溶 |
| 实验操作 | 测定结果 | 白色固体成分 |
| 用玻璃棒蘸取溶液滴到pH试纸上,把试纸显示的颜色与标准比色卡比较。 | | CaCl2、Ca(OH)2 |
| pH≤7 | |





 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源:不详 题型:实验题
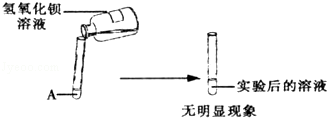
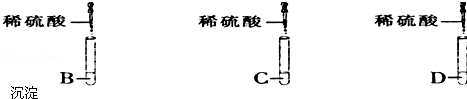
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
| 序号 | 实验步骤 | 实验现象 | 结论 |
| I | 在两个蒸发皿中各加入lOmL 冷水,控制相同燃烧条件,分别用 乙醇和汽油作为燃料进行加热,记 录从开始加热到水沸腾的时间。 | 用乙醇加热耗时118s; 用汽油加热耗时56s。 | 猜想2 (填“成立"或 “不成立"); |
| Ⅱ | 实验l停止加热后,取下蒸发 皿,观察蒸发皿的底部。 | 用乙醇加热的蒸发皿底部 只有极少量炭黑,而用汽油加热 的蒸发皿底部有大量炭黑。 | (可仿照上格填写) |
查看答案和解析>>
科目:初中化学 来源:不详 题型:单选题

| A.水和氢氧化钠固体 |
| B.稀硫酸和镁条 |
| C.水和硝酸铵 |
| D.稀盐酸和生石灰 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
| 实验操作 | 实验现象 | 实验结论 |
| 取一定量纯碱样品配成溶液后,滴加过量的CaCl2溶液。 | 产生白色沉淀 | 反应的化学方程式: |
查看答案和解析>>
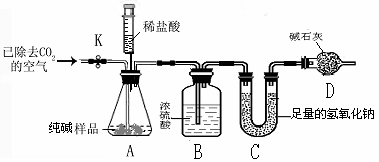
科目:初中化学 来源:不详 题型:实验题
查看答案和解析>>
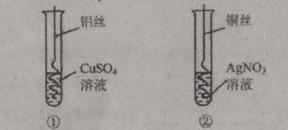
科目:初中化学 来源:不详 题型:实验题
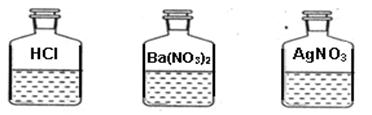
查看答案和解析>>
科目:初中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
| 实验方法和步骤 | 实验现象(预期) | 分析 |
| | | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com