
| A. | 置换反应 | B. | 分解反应 | C. | 化合反应 | D. | 复分解反应 |
 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 饱和溶液析出晶体后,其溶质的质量分数可能不变 | |
| B. | 少量的固体物质溶于水,能使稀溶液的凝固点降低,沸点升高 | |
| C. | 同种溶质的饱和溶液,一定比它的不饱和溶液的溶质质量分数大 | |
| D. | 溶液具有导电性的原因,是因为其中含有自由移动的离子 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
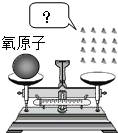 在学习相对原子质量的时候,课本上引用了如图所示的模型图.根据相对原子质量的定义,盘中的每一小块表示的是( )
在学习相对原子质量的时候,课本上引用了如图所示的模型图.根据相对原子质量的定义,盘中的每一小块表示的是( )| A. | 一个碳原子质量的 $\frac{1}{12}$ | B. | 一个氧原子质量的 $\frac{1}{16}$ | ||
| C. | 一个碳原子的质量 | D. | 一个氢原子的质量 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
 2015年2月,中德科学家成功合成了具有优异的电化学性能的钒的氧化物(V6O13),钒元素的相关信息如图.下列有关钒的说法错误的是( )
2015年2月,中德科学家成功合成了具有优异的电化学性能的钒的氧化物(V6O13),钒元素的相关信息如图.下列有关钒的说法错误的是( )| A. | 原子的核外电子数是23 | B. | 原子核内的中子数是28 | ||
| C. | 相对原子质量为50.94 | D. | 属于稀有气体元素 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验操作 | 实验现象 | 实验结论 |
| ①取少量样品于试管中,加入适量盐酸,塞上带导管的单孔塞 把导管插入另一试管里的石灰水中. | 有气体产生,气体使石灰水变浑浊. | 猜想2成立 |
| ②在上述反应后的试管中加少量品红溶液. | 品红溶液褪色. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com