
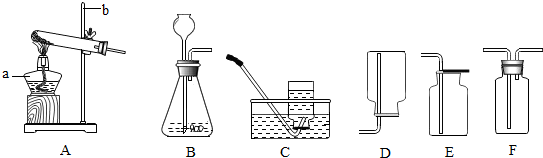
分析 (1)根据常见的夹持仪器,进行分析解答.
(2)根据给试管中的液体加热的方法、酒精灯的使用方法,进行分析解答.
(3)用量筒量取液体时,量筒要放平,读数时视线应与凹液面最低处相平;如果仰视液面,读数比实际偏小,若俯视液面,读数比实际偏大.
解答 解:(1)用于夹持试管的仪器是试管夹,应夹在试管的中上部.
(2)给试管中的液体加热,应先进行预热,且液体体积不能超过试管容积的$\frac{1}{3}$,添加酒精,不能超过酒精灯容积的$\frac{2}{3}$.
(3)量取10毫升某液体时,如果俯视量筒的刻度 (其他操作无误),其读数会比实际偏大,那么实际体积应小于10mL.
故答案为:(1)试管夹;中上;(2)预热;$\frac{1}{3}$;$\frac{2}{3}$;(3)<.
点评 本题难度不大,熟悉各种仪器的用途及使用注意事项、常见化学实验基本操作的注意事项是解答此类试题的关键.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 集气瓶口有气泡冒出 | B. | 将集气瓶移出水面观察 | ||
| C. | 集气瓶中还有少量水 | D. | 集气瓶内有气泡冒出 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题


查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | Zn能与AgNO3溶液反应置换出Ag | |
| B. | Zn能与稀硫酸反应,Ag则不能 | |
| C. | Zn的熔点为420℃,Ag的熔点为962℃ | |
| D. | 自然界没有以单质形式存在的Zn,而有以单质形式存在的Ag |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验编号 | 实验操作 | 实验现象 |
| ① | 加入适量稀盐酸 | 有微量气泡,固体全部溶解,得到澄清溶液 |
| ② | 加入适量蒸馏水 | 固体部分溶解 |
| ③ | 加入适量无水乙醇 | 固体部分溶解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com