
有一铁粉与铜粉的混合物,置入一定质量的![]() 溶液中,恰好完全反应,得到152g质量分数为20%的
溶液中,恰好完全反应,得到152g质量分数为20%的![]() 溶液。同时得到固体物质19.2g。求:(1)原混合物中铜粉的质量分数。(2)原
溶液。同时得到固体物质19.2g。求:(1)原混合物中铜粉的质量分数。(2)原![]() 溶液的质量及质量分数。
溶液的质量及质量分数。
|
36.4% 20.8% 反应中生成的 设原混合物中铁粉的质量为
56 160 152 64
原混合物中铜粉的质量=19.2g-12.8g=6.4g 原混合物中铜的质量分数 原 原 |
|
铁粉与铜粉放入 |


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:初中化学 来源:学习周报 化学 沪教课标中考版 2009-2010学年 第13期 总169期 题型:059
问题情境:科学探究是奇妙的过程,它在巩固学生所学知识的同时,也开阔了学生分析问题、解决问题的视野.从而让学生认识到生活中处处有化学,化学就在我们身边,应注意留心身边发生的每一件事情.
为了准备好今天下午金属的化学性质实验,睿睿所在的化学兴趣小组正在帮老师整理实验仪器和药品.不经意间睿睿发现有一瓶盛有铜粉的试剂,和其他的不一样,颜色比较浅,难道这里面混进了其他金属?经询问老师才知道,这瓶铜粉是为了做探究实验用的,并且里面只混进了一种能与稀酸反应的+2价金属.
猜想与假设:她们依据今天实验所用的金属,大胆地做出了下面的猜测:
观点1:从颜色上看,很可能是混进了镁粉;
观点2:从颜色上看,很可能是混进了________;
观点3:从颜色上看,很可能是混进了________.
查阅资料:(1)镁、铁、锌皆能与稀硫酸发生置换反应,且生成+2价的可溶性金属化合物和氢气.
(2)相对原子质量:Mg-24、Fe-56、Zn-65.
实验步骤:
1.设计思路:根据铜不与稀硫酸反应,取一定量的样品向里面分次加入足量的稀硫酸,最终剩余的不反应的就是铜,测出铜的质量就可以知道未知金属的质量,然后计算所消耗的稀硫酸的质量,根据化学方程式就可以计算出未知金属的相对原子质量,从而判断所混进的是什么金属.
2.操作步骤:取该混合物粉末8.0 g放入烧杯中,将140.0 g 14.0%的稀硫酸分四次加入该烧杯中,充分反应.
3.数据处理:测得剩余固体质量数据记录如下:

请根据上述实验数据,完成以下问题:
问题讨论:(1)稀硫酸加到第________次时已经过量.
(2)该混合物中铜粉的质量为________.
组成确定:该混合物粉末中另一金属为何种金属?(写出计算过程)
实验结论:________________.
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

| 合金 | 合金的主要性能 | 主要成分及纯金属的性能 |
| 焊锡 | 熔点183℃ | 锡:熔点232℃;铅:熔点327℃. |
| 硬铝 | 强度和硬度好 | 铝、铜、镁等.硬度小,质软. |
| 不锈钢 | 抗腐蚀性好 | 铁、铬、镍等.纯铁易生锈. |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
请你参与下列探究。
【问题情景】某化学实验小组同学将铁粉投入硫酸铜溶液中,发现生成红色固体物质的同时,有较多的气泡放出。这一现象激发起同学们的探究欲望,生成的是什么气体呢?
【提出猜想】从物质组成元素的角度分析,放出的气体可能是SO2、O2、H2。
【查阅资料】SO2易溶于水,它能与NaOH溶液反应,生成Na2SO3和H2O。浓硫酸是干燥剂,能吸水。
【方案设计】依据上述猜想,实验小组同学分别设计了如下方案:
(1)甲同学认为是O2,则检验方法是 。
(2)乙同学认为是SO2,则只需将放出的气体通入盛有NaOH溶液的洗气瓶中,称量通气前后洗气瓶的质量。写出SO2与NaOH反应的化学方程式: 。
(3)实验小组同学合 作设计了如下组合实验方案,排除和验证猜想的气体。
作设计了如下组合实验方案,排除和验证猜想的气体。
 |
如果放出的是O2和H2的混合物,你认为方案中的安全隐患是 。
丙同学认为:为确保安全,实验前应先收集一试管气体,用拇指 ,若不发出 ,方可采用上面的装置进行实验。
 【实验探究】经丙同学确认安全后,小组同学首先对装置A进行称量,再将收集到的气体从a通入,过一会儿点燃B处酒精灯;一段时间后,发现表面含CuO的铜网由黑色变为光亮的红色;停止通气,再次称量装置A,发现质量不变。
【实验探究】经丙同学确认安全后,小组同学首先对装置A进行称量,再将收集到的气体从a通入,过一会儿点燃B处酒精灯;一段时间后,发现表面含CuO的铜网由黑色变为光亮的红色;停止通气,再次称量装置A,发现质量不变。
结论:(4)铁粉与硫酸铜溶液反应时,产生的气体是 。
(5)写出H2还原CuO的化学方程式: 。
【思维拓展】
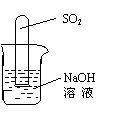
(6) 不通过称量,如何判断SO2与NaOH溶液发生了反应呢?有一同学设计了
右图所示的装置进行实验,发现试管内液面上升,就得出SO2与NaOH溶
液发生反应的结论。其他同学认为这一方案不严谨,理由是 。
查看答案和解析>>
科目:初中化学 来源: 题型:
金属材料在生活、生产中应用十分广泛。
(1)下图A是金属的一个应用实例,其利用金属的主要性质是 ;下图B是两块金属片相互刻划后,在纯铜片上有明显的划痕。由此可得到的结论是 。
(2)下列四个实验中,铁钉最易生锈的是 (填字母)。
A B C D
(3)写出工业上用一氧化碳与赤铁矿冶炼生铁的化学方程式 。
(4)把某稀硫酸分为等体积的两份,放入两个烧杯中,分别加入等质量的锌、铁两种金属,反应后金属都没有剩余,产生氢气的质量随反应时间变化曲线如图。下列说法正确的是 (填字母)。
A.甲是铁,乙是锌
B.铁消耗硫酸的质量比锌大
C.参加反应的锌的质量小于铁的质量
D.充分反应后,稀硫酸一定都有剩余
(5)将一定量铁粉加入到AgNO3、Cu(NO3)2、Zn(NO3)2的混合溶液中,充分反应后过滤,向滤渣中加入稀盐酸没有明显现象,则滤渣和滤液中溶质的组成可能为 (填字母)。
选项 滤渣 滤液
A 铜和银 Fe(NO3)2和Zn(NO3)2
B 银 Cu(NO3)2、Fe(NO3)2和Zn(NO3)2
C 铜和银 Cu(NO3)2、Fe(NO3)2和Zn(NO3)2
D 银 AgNO3、Cu(NO3) 2、Fe(NO3)2和Zn(NO3)2
E 铜和银 AgNO3、Cu(NO3)2、Fe(NO3)2和Zn(NO3)2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com