
 红枣中含有丰富的VC和糖类,常食能增强人体的免疫力,有补血养气安神等良好功效,红枣包装中常使用一种袋装防腐剂,品名为“504双吸剂”,其标签如图所示.某化学兴趣小组对一包久置的“504双吸剂”固体样品产生浓厚的兴趣,设计实验进行探究.
红枣中含有丰富的VC和糖类,常食能增强人体的免疫力,有补血养气安神等良好功效,红枣包装中常使用一种袋装防腐剂,品名为“504双吸剂”,其标签如图所示.某化学兴趣小组对一包久置的“504双吸剂”固体样品产生浓厚的兴趣,设计实验进行探究.| 实验操作 | 实验现象 | 实验结论 |
| 取少量固体于试管中,滴加足量的稀盐酸 | 固体逐渐消失,有大量无色气体产生,得到浅绿色溶液. | 固体中一定含有Fe, 一定不含Fe2O3. |

| 实验操作 | 实验现象 | 实验结论 |
| 取少量固体于试管中,滴加足量的稀盐酸,并将气体通入澄清石灰水 | 固体逐渐消失有气泡产生、澄清石灰水变浑浊,澄清石灰水变浑浊 溶液呈黄色. | 固体中一定含有CaCO3和Fe2O3. |
分析 本题探究了防腐剂的成分,取少量固体放于试管中,滴加足量的稀盐酸,固体逐渐消失,有大量无色气体产生,得到浅绿色溶液,固体中一定含有铁,不一定不含Fe2O3理由是:氧化铁和盐酸反应生成氯化铁,铁和氯化铁反应生成氯化亚铁,溶液也是浅绿色.
(1)由乙同学的设计方案可知:磁铁吸引了铁粉,②中固体溶解时放出大量热,因为生石灰溶于水生成熟石灰放出大量的热,由此可以判断固体中一定含有氧化钙;滤液A中的氢氧化钙和碳酸钠反应生成碳酸钙白色沉淀和氢氧化钠,配平即可;
对滤渣B又进行探究:①取滤渣B于试管中,加入适量稀盐酸,固体减少,有气泡冒出,溶液变为黄色;②将生成的气体通入澄清石灰水,澄清石灰水变浑浊;固体中一定含有CaCO3和Fe2O3.
解答 解:甲同学的方案:取少量固体放于试管中,滴加足量的稀盐酸,固体逐渐消失,有大量无色气体产生,得到浅绿色溶液,固体中一定含有铁.北北同学不一定不含Fe2O3理由是:氧化铁和盐酸反应生成氯化铁,铁和氯化铁反应生成氯化亚铁,溶液也是浅绿色.
(1)步骤①样品用磁铁吸引前需经过研碎,研碎的目的是 增大接触面积,使反应充分
(2)由乙同学的设计方案可知:磁铁吸引了铁粉,②中固体溶解时放出大量热,因为生石灰溶于水生成熟石灰放出大量的热,由此可以判断固体中一定含有氧化钙;反应的化学方程式为CaO+H2O=Ca(OH)2
(3)滤液A中的氢氧化钙和碳酸钠反应生成碳酸钙白色沉淀和氢氧化钠,化学方程式为:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
对滤渣B的探究:①根据实验结论,固体中一定含有碳酸钙和氧化铁,因此取滤渣B于试管中,加入适量稀盐酸;②将生成的气体通入澄清石灰水,可看到固体减少,有气泡冒出,溶液变为黄色,澄清石灰水变浑浊;
故答案为:甲同学的方案:稀盐酸(或稀硫酸) Fe(或铁粉)
乙同学的理由:氧化铁与稀盐酸(或稀硫酸)反应生成的氯化铁(或硫酸铁)又与铁粉反应生成氯化亚铁(或硫酸亚铁).
(1)增大接触面积,使得铁粉能够充分吸引;
(2)CaO(或氧化钙);
(3)Ca(OH)2+Na2CO3═CaCO3↓+2NaOH;
乙同学的探究:澄清石灰水变浑浊; 溶液呈黄色.
点评 有关实验方案的设计和对实验方案的评价是中考的热点之一,设计实验方案时,要注意用最少的药品和最简单的方法;关于对实验设计方案的评价,要在两个方面考虑,一是方案是否可行,能否达到实验目的;二是设计的方法进行比较,那种方法更简便.本考点主要出现在实验题中.


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:推断题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
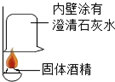 近几年餐饮行业经常使用一种“固体酒精”,替代相对不够安全的液体酒精,化学兴趣小组的同学对“固体酒精”产生了好奇,并对其成分进行研究.
近几年餐饮行业经常使用一种“固体酒精”,替代相对不够安全的液体酒精,化学兴趣小组的同学对“固体酒精”产生了好奇,并对其成分进行研究.| 方案 |  |  |
| 现象 | 溶液变红 | 产生白色沉淀 |
| 结论 | 溶液中有氢氧化钠 | 溶液中有碳酸钠 |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 如图是实验室用CO还原Fe2O3的实验装置,请回答:
如图是实验室用CO还原Fe2O3的实验装置,请回答:查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
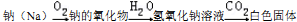
| 实验操作 | 实验现象 | 实验结论 |
| 取少量钠的氧化物加入足量蒸馏水 | 猜想1正确 |
| 实验操作 | 实验现象 | 实验结论 |
| 1.取少量白色固体加入足量氯化钙溶液 | 产生白色沉淀 | 白色固体成分为Na2C03和 NaOH |
| 2.过滤、取少量滤液加入无色的酚酞试液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com