
【题目】为测定镁和硫酸镁固体混合物中镁元素的质量分数,先称取混合物10g,放入一干净的烧杯中,然后取一定溶质质量分数的稀硫酸100g,平均分五次加入其中,充分振荡,实验所得数据如下表:
第1次 | 第2次 | 第3次 | 第4次 | 第5次 | |
加入稀硫酸的质量/g | 20 | 20 | 20 | 20 | 20 |
生成气体的总质量/g | 0.12 | x | 0.36 | 0.4 | y |
(l)上表中x=_______、y=_______.
(2)固体混合物中镁元素的质量分数为__________.
(3)所用稀硫酸的溶质质量分数为_____?
【答案】 0.24 0.4 58.4% 26.95%
【解析】(l)第一个20g稀硫酸对应0.12g氢气,而第三个20g对应的氢气为0.36g,说明每加入20g稀硫酸生成0.12g氢气,到第四次时应该为0.48g实际为0.4g,说明金属已经完全反应,所以氢气质量不再增加,所以x=0.24,y=0.4;
(2)设10g混合物中镁单质的质量为x。
Mg+H2SO4=MgSO4+H2↑
24 2
x 0.4g
![]()
x=4.8g
固体混合物中镁元素的质量分数为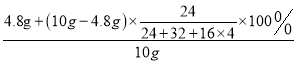 ×100%=58.4%
×100%=58.4%
(3)每加入20g稀硫酸生成0.12g氢气,设20g稀硫酸中溶质的质量为y。
Mg+H2SO4=MgSO4+H2↑
98 2
y 0.12g
![]()
y=5.39g
所用稀硫酸的溶质质量分数为![]() ×100%=26.95%
×100%=26.95%
答:(l)上表中x=0.24、y=0.4;(2)固体混合物中镁元素的质量分数为 58.4%;(3)所用稀硫酸的溶质质量分数为26.95%。


科目:初中化学 来源: 题型:
【题目】分类是学习化学常用的方法.
(1)保护金属资源是每一个公民的义务.请根据下列保护金属资源的事例中所体现的保护金属资源的途径将它们分类,并参照实例完成空白处内容.(填一条即可)
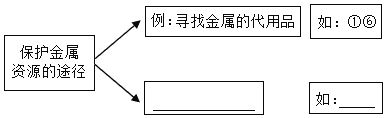
___________ 如:__________
①用塑料代替钢制造管道、汽车零部件等
②给自行车的链条涂油
③用汽车用过的铅酸蓄电池再生铅
④在水龙头表面镀铬
⑤用废电池的锌皮做制取氢气的实验
⑥机器使用氮化硅陶瓷齿轮
(2)一年多的化学学习中,我们经历了很多实验,若按照是否“用数量表示资料或信息”可将实验分为“定性实验”和“定量实验”.若依照上述此标准,可将下列实验中的A与①_____(填“B”或“C”)归为一类,请你再写出一个你学过的定量实验②_____.
|
|
|
A | B | C |
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】小刚收集到一瓶浑浊的长江水,他要模拟自来水厂的净水过程,最终制成自来水.其实验过程如图所示:
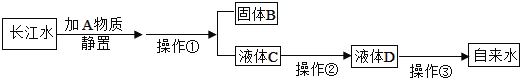
请回答以下问题.
(1)操作①的名称是_____;该操作中用到的玻璃仪器有玻璃棒、烧杯和_____,其中玻璃棒的作用是_____.
(2)操作②主要是用活性炭除去一些异味和色素,其净水原理是利用活性炭的_____作用,该过程主要是_____变化(填“物理”或“化学”).
(3)硬水给生活和生产带来很多麻烦,生活中常常用_____方法来降低水的硬度.
(4)操作③是消毒杀菌,该过程主要是_____变化(填“物理”或“化学”).
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】徐州地区石灰石资源丰富。某化学兴趣小组称取4.0g石灰石样品,把40g稀盐酸分4次加入样品中(假设杂质不反应也不溶解),得实验数据如下:
稀盐酸的用量 | 剩余固体的质量 |
第一次加入10g | 3.0g |
第二次加入10g | 2.0g |
第三次加入10g | 1.0g |
第四次加入10g | 0.6g |
请计算:
(1)4.0g石灰石样品中碳酸钙的质量是____g。
(2)10g稀盐酸能与_____g碳酸钙正好完全反应。
(3)求稀盐酸的溶质质量分数为_________(写出计算过程,结果精确到0.1%)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】【题目】目前,农业上使用最多的氮肥主要有尿素、硝酸铵和碳酸氢铵等,其中硝酸铵的生产原理是利用安翠华氧化得到的硝酸,再跟氨反应生产硝酸铵,基本流程如下:
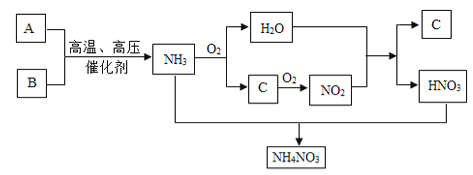
已知:①上述流程图中A、B、C均为气体,其中A、B为单质且A的相对分子质量为28,C为含有A组成元素的化合物;氨与氧气反应的条件是高温、催化剂.
②在化学反应中,只要有物质所含元素的化合价发生了变化的反应就是氧化还原反应.例如:2Na+2H2O═2NaOH+H2↑,反应前后,Na元素、H元素的化合价分别发生了变化,该反应是氧化还原反应.
请回答下列问题:
(1)写出A、C两种物质的化学式:A为_______;C为_______.
(2)NH3和O2反应的化学方程式为_________________.
(3)上述流程图的5个反应中有______个属于氧化还原反应.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】用研磨成粉末的雄黄(化学式As4S4,化学名称为四硫化四砷)泡制的白酒或黄酒称为雄黄酒,是我国传统节日﹣端午节的饮品,也是我国古代人们在夏季除害灭病的主要消毒药剂:雄黄(化学式As4S4),可用作颜料、还原剂和药物等;砒霜(化学式As2O3)是一种剧毒物质,由于古代的生产技术落后,致使砒霜里混有少量的硫和硫化物.当银与砒霜中所含的硫接触时,就可发生化学反应,使银的表面生成一层黑色的硫化银.
(1)雄黄和雌黄两种物质中,硫元素的含量较高的是_________(填化学式).
(2)砒霜(化学式As2O3)的化学名称为_________.
(3)硫化银的化学式为________.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某工厂欲从只含有硫酸铜的废液中回收金属铜,并得到工业原料硫酸亚铁,其工业流程如下:
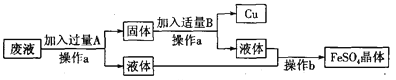
(1)操作a、b的名称分别是_______、_______。
(2)写出流程中有关反应的化学方程式:_______、_______。以上两个反应能够发生的原因是____________________________________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】右图是元素周期表中钙元素的信息示意图,对图中信息理解不正确的是:
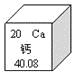
A. 属于非金属元素
B. 质子数为20
C. 元素符号为Ca
D. 相对原子质量为40.08
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com