
【题目】将100克氯化钾样品(含碳酸钾)加入50克盐酸中完全反应,气体全部逸出,得到145.6克溶液。则:
(1)产生的气体质量为多少克?
(2)计算样品中氯化钾的质量分数。
【答案】(1)根据质量守恒定律,减少的质量即是生成的二氧化碳的质量,即100g+50g-145.6g=4.4g。
(2)设样品中碳酸钾的质量为x。
K2CO3+2HCl ![]() 2KCl+CO2↑+H2O
2KCl+CO2↑+H2O
138 44
x 4.4g
![]() x=13.8g
x=13.8g
样品中碳酸钾的质量为100g-13.8g=86.2g
样品中碳酸钾的质量分数为 ![]() =86.2%.
=86.2%.
【解析】(1)根据质量守恒定律,减少的质量即是生成的二氧化碳的质量,即100g+50g-145.6g=4.4g。
(2)设样品中碳酸钾的质量为x
K2CO3+2HCl=2KCl+CO2↑+H2O
138 44
x 4.4g
![]()
x=13.8g
样品中碳酸钾的质量为100g-13.8g=86.2g
样品中碳酸钾的质量分数为![]() ×100%=86.2%
×100%=86.2%
答:样品中碳酸钾的质量分数为86.2%。


 计算高手系列答案
计算高手系列答案科目:初中化学 来源: 题型:
【题目】如下图所示,实验室用过氧化氢溶液和二氧化锰制取氧气。现将1.1g二氧化锰放入30.2g过氧化氢溶液的锥形瓶中,立即塞紧带导管的橡胶塞,待反应结束后,锥形瓶内剩余物的质量为29.7g。
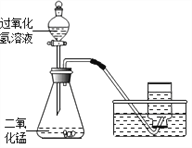
⑴反应中二氧化锰的作用是_______________。
⑵反应结束后,可通过________(填操作名称),得到二氧化锰。
⑶计算参加反应的过氧化氢的质量,写出必要的计算过程____________。(结果精确到0.1 g)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】火柴头上的深色物质主要成分是KClO3、MnO2和Sb2S3(硫化锑),火柴盒侧面涂有一层红褐色物质,主要成分是红磷(P)和玻璃粉.划火柴时,借助摩擦产生的热,KClO3在MnO2催化下放出O2 , 使红磷燃烧.同时Sb2S3也可与O2反应生成Sb2O3和一种气体.Sb2S3燃烧生成Sb2O3和一种气体的化学方程式为 ( )
A. Sb2S3+8O2 ![]() Sb2S3+3SO2 B. Sb2O3+9O2
Sb2S3+3SO2 B. Sb2O3+9O2 ![]() Sb2O3+3SO2
Sb2O3+3SO2
C. 2Sb2S3+8O2 ![]() 2Sb2O3+6SO2 D. 2Sb2S3+9O2
2Sb2O3+6SO2 D. 2Sb2S3+9O2 ![]() 2Sb2O3+6SO2
2Sb2O3+6SO2
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】空气是一种宝贵的资源。
(1)洁净的空气属于_________(填“混合物”或“纯净物”)
(2)据报道,今年1~4月南京空气中PM2.5与去年同期相比下降22.3%,下列行为不会增加空气中PM2.5的是_________。
A.燃煤火力发电 B.治理工地扬尘 C.露天焚烧垃圾 D.使用氢能源汽车
(3)氢气具有广泛用途,它是制造硝酸和氮肥的重要原料。写出含有氮元素的常见氧化物、酸、碱、盐的化学式各一个,并标出所写化学式中氮元素的化合价。
氧化物____________、酸____________、碱____________、盐____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列说法正确的是( )
A.饱和溶液析出晶体后,溶质的质量分数一定减少
B.常温下KNO3、Ca(OH)2的饱和溶液降温后仍是饱和溶液
C.将NaCl、蔗糖溶于水后,溶质均以分子形式存在
D.20℃时100g10%的氯化钠溶液中,氯化钠与水的质量比为1:9
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某同学设计了测定空气中氧气含量的实验,实验装置如图.该同学的实验步骤如下:
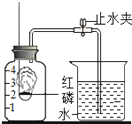
①将图中的集气瓶分为5等份,并作好标记.②在带橡皮塞和导管的燃烧匙内装入足量的红磷,将导管上的止水夹夹紧,在酒精灯上点燃红磷,并立即伸入集气瓶内,塞紧橡皮塞.③充分反应后,待集气瓶冷却至室温,打开止水夹.
请回答下列问题:
(1)该实验中红磷需稍过量,目的是______.
(2)步骤②集气瓶中的现象是_________________________,其反应的文字表达式为__________________;步骤③中打开止水夹后观察到的现象是_____________________________,由此可得出空气中氧气的体积分数约为___.
(3)该实验可推论出氮气__(填“易”或“难”)溶于水和其化学性质_____(填“活泼”或“不活泼”)的结论.
(4)若将红磷换成炭粉,该实验能否获得成功?为什么?_____成功,原因是______________________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com