
| 100 |
| x |
| 73 |
| 100g×y |
| 111 |
| z |
| 44 |
| 4.4g |
| 10g |
| 15g |
| 11.1g |
| 110.6g-(15g-10g) |


科目:初中化学 来源: 题型:
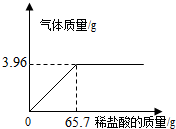 课题小组为测定某石灰石样品中CaCO3的含量,取l0g石灰石样品放在烧杯中,然后向其中注入一定量某质量分数的稀盐酸,使之与样品充分反应(杂质不参与反应).随反应进行,注入稀盐酸的质量与反应得到气体的质量呈如图所示关系.请完成下列计算内容:
课题小组为测定某石灰石样品中CaCO3的含量,取l0g石灰石样品放在烧杯中,然后向其中注入一定量某质量分数的稀盐酸,使之与样品充分反应(杂质不参与反应).随反应进行,注入稀盐酸的质量与反应得到气体的质量呈如图所示关系.请完成下列计算内容:查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com