
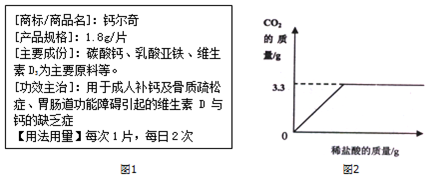
分析 根据图中给出的二氧化碳的质量结合二氧化碳的密度求算对应的体积,结合二氧化碳的质量和对应的化学方程式求算碳酸钙的质量,进而求算药品中碳酸钙的质量分数.
解答 解:
(1)二氧化碳的体积等于$\frac{3.3g}{2.0g/L}$=1.65L.
(2)设生成3.3g二氧化碳需要的碳酸钙的质量为x.
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 3.3g
$\frac{100}{44}$=$\frac{x}{3.3g}$
x=7.5g
则样品中碳酸钙的质量分数为$\frac{7.5g}{1.8g×5}$×100%≈83.3%
答:(1)完全反应产生的二氧化碳的体积为 1.65L;
(2)该药片中碳酸钙的质量分数为83.3%.
点评 根据质量求气体的体积应该是质量除以密度,这个很多学生会错误计算为质量乘以密度.


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
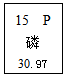
| A. | 相对原子质量是15 | B. | 原子序数是15 | ||
| C. | 该元素属于金属元素 | D. | 一个磷原子的质量是30.97g |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:推断题

查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com