
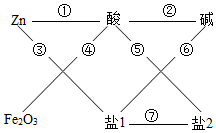
 稀硫酸(H2SO4)、氢氧化钠(NaOH)、氯化钡(BaCl2)、硫酸铜(CuSO4)等溶液可参与如图所示的七大化学变化
稀硫酸(H2SO4)、氢氧化钠(NaOH)、氯化钡(BaCl2)、硫酸铜(CuSO4)等溶液可参与如图所示的七大化学变化分析 由于给出的是四种物质和图对应的关系,所以酸和碱是一定的,而给定物质中能和酸反应的盐是氯化钡即盐2为氯化钡,而和碱能反应的盐是硫酸铜即盐1为硫酸铜.因此可对应出物质之间的关系.
解答 解:
由于给出的酸碱各有一种,所以酸是硫酸,碱为氢氧化钠,而给定的两种盐只有氯化钡能和硫酸反应,而和碱反应的盐只是硫酸铜,所以转化关系为: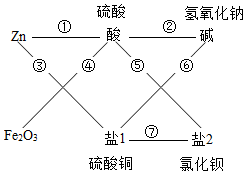
(1)盐1是 CuSO4.
(2)反应④是氧化铁和硫酸反应,生成硫酸铁和水,在工业上,反应④的用途为 除锈,该反应生成含铁的化合物的化学式是 Fe2(SO4)3.
(3)由于图中的锌既能和硫酸反应,也能和硫酸铜反应,而银活动性弱不能和稀硫酸反应,其活动性也比铜弱,所以也不能和硫酸铜反应,所以不能用银替代图中的锌,其理由有二,理由之一是 银的金属活动性弱不能与稀硫酸发生反应或银的金属活动性弱不能置换硫酸铜中的铜.
(4)中和反应是酸和碱反应生成盐和水,对应的是硫酸和氢氧化钠反应生成硫酸钠和水,对应的化学方程式为H2SO4+2NaOH=Na2SO4+2H2O.
故答案:
(1)CuSO4;
(2)除锈;Fe2(SO4)3;
(3)银的金属活动性弱不能与稀硫酸发生反应或银的金属活动性弱不能置换硫酸铜中的铜;
(4)H2SO4+2NaOH=Na2SO4+2H2O.
点评 结合给定物质的性质和转化关系进行物质的位置确定,然后结合给出的问题进行分析解答.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:初中化学 来源: 题型:多选题
| 选项 | 物质 | 杂质 | 除杂方法 |
| A | CO2 | CO | 点燃 |
| B | MnO2粉 | C粉 | 在空气中充分灼烧 |
| C | FeSO4溶液 | CuSO4溶液 | 加入足量的铁粉,过滤 |
| D | NaCl固体 | 泥沙 | 溶解、过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
 往100g含有盐酸和氯化钙的混合溶液中,加入21.2%的碳酸钠溶液,所得溶液的pH变化与加入碳酸钠溶液的质量关系如图,试分析计算:
往100g含有盐酸和氯化钙的混合溶液中,加入21.2%的碳酸钠溶液,所得溶液的pH变化与加入碳酸钠溶液的质量关系如图,试分析计算:查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
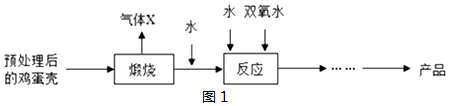
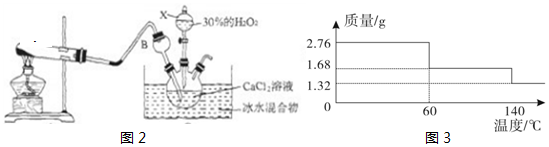
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A、对性质和用途的认识 | B、资源的利用和保护 |
| ①一氧化碳有可燃性,可用于冶炼金属 ②石墨很软,可以制成电极 | ①爱护水资源要节约用水和防止水体污染 ②保护金属资源只能通过防止金属腐蚀实现 |
| C、“生活中安全”的措施 | D、用“化学”眼光分析 |
| ①在室内一盆水能防止煤气中毒 ②夜间发现液化气泄漏开灯寻找泄漏源 | ①洗涤剂去油污是因为起乳化作用 ②湿衣服晾干是因为分子不断运动 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 碳原子核,含7个质子,8个中子 | B. | 氧原子核,含7个质子,8个中子 | ||
| C. | 碳原子核,含6个质子,7个中子 | D. | 氮原子核,含7个质子,7个中子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com