


科目:初中化学 来源: 题型:阅读理解

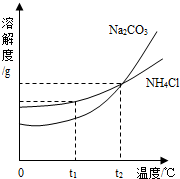 (3)我国化学科学家侯德榜创立的侯氏制碱法,就是以海水“晒盐”得到的氯化钠为原料,同时制得Na2CO3和NH4Cl产品.Na2CO3和NH4Cl的溶解度曲线如图所示.回答下列问题:
(3)我国化学科学家侯德榜创立的侯氏制碱法,就是以海水“晒盐”得到的氯化钠为原料,同时制得Na2CO3和NH4Cl产品.Na2CO3和NH4Cl的溶解度曲线如图所示.回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 实验步骤 | 实验现象 | 实验结论 |
| 取袋内固体与一定量的水混合后于烧杯中,充分搅拌后过滤,向滤液中 通入二氧化碳 通入二氧化碳 . |
溶液变浑浊 溶液变浑浊 |
猜想2正确 |
| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 物 质 | Ca(HCO3)2 | Mg(HCO3)2 | Ca(OH)2 | Mg(OH)2 | CaCO3 | MgCO3[来源:] |
| 溶解性 | 可溶 | 可溶 | 微溶 | 不溶 | 不溶 | 微溶 |

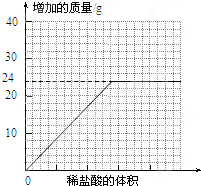
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 实验目的 | 探究下列物质溶解前后液体温度变化情况 |
| 实验用品 | 药匙、烧杯、玻璃棒、温度计、水、氢氧化钠、氯化钠、硝酸铵 |
| 操作过程 | 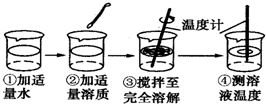 |
查看答案和解析>>
科目:初中化学 来源:课堂三级讲练化学 九年级(上) 题型:059
(1)学生甲取一支蜡烛,发现是白色的固体.该学生做下列实验:

①从蜡烛上用小刀切下两块石蜡,将一块放入水中,发现它不溶于水,浮于水面.
②将另一块石蜡放在如图所示装置上加热,发现石蜡很快熔化.
③根据学生甲的实验,你能总结出石蜡有哪些性质?
(2)学生乙观察蜡烛燃烧时的现象:
①蜡烛火焰分为________层(如图a所示),蜡烛边燃烧边________.将一块铝片放在火焰上,一段时间后,发现铝片上有________色的物质生成,该物质是________.②取一干燥的烧杯放置在火焰上方,烧杯内壁上有________出现.取下烧杯,迅速向烧杯中倒入少量澄清石灰水,振荡,发现石灰水说明蜡烛燃烧生成了________(如图b).

(3)学生丙观察到蜡烛熄灭后出现白烟,它是怎样形成的(如图c)?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com