某化验员对炼铁厂购进的赤铁矿石(主要成分为Fe2O3)样品进行分析,取20g该样品加入稀盐酸中,完全反应后,共用去184g稀盐酸,过滤得滤渣4.0g(杂质既不溶于酸也不溶于水)该反应原理是:Fe2O3+6HCl=2FeCl3+3H2O,求:
(1)该赤铁矿石样品中的Fe2O3的质量分数?
(2)稀盐酸的溶质质量分数?
(3)反应后所得的溶液中溶质质量分数?
【答案】
分析:(1)由题意可知赤铁矿石中的杂质既不容易酸,也不溶于水,而且该题目中涉及的化学反应也不会生成沉淀,所以滤渣的质量就是赤铁矿石中杂质的质量.那么样品中Fe
2O
3的质量=用样品的质量-杂质的质量.
(2)由氧化铁的质量根据氧化铁与稀盐酸反应的化学方程式可以计算出稀盐酸中溶质的质量分数.
(3)根据题意反应后溶质是FeCl
3,可以根据化学方程是求出其质量.反应后所得溶液的质量=反应前所以物质的质量-杂质的质量.即可求出反应后溶液中溶质的质量分数.
解答:解:(1)依据题意可知,赤铁矿中氧化铁的质量为:20.0g-4.0g=16.0g;
赤铁矿石样品中的Fe
2O
3的质量分数为

×100%=80.0%
(2)设反应后生成FeCl
3的质量为x,消耗氯化氢的质量是y;
Fe
2O
3+6HCl═2FeCl
3+3 H
2O
160 219 325
16.0g y x
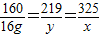
x=32.5g
y=21.9g
稀盐酸的溶质质量分数

×100%=11.9%
(3)反应后所得FeCl
3溶液的质量为:20.0g+184.0g-4.0g=200.0g
反应后所得FeCl
3溶液的质量分数为:
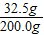
×100%=16.25%
答:(1)赤铁矿石样品中Fe
2O
3的质量为16.0g,其纯度为80.0%
(2)稀盐酸的溶质质量分数11.9%;
(3)反应后所得溶液中溶质的质量分数为16.25%
点评:求反应后所得溶液的质量的计算是初中化学计算的一个重点内容,其方法一般是:所加入的所有物质的质量总和-生成气体的质量-生成沉淀的质量.

 ×100%=80.0%
×100%=80.0% 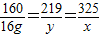
 ×100%=11.9%
×100%=11.9%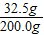 ×100%=16.25%
×100%=16.25% 

 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案