

分析 (1)根据实验室常用仪器的名称和题中所指仪器的作用进行分析;
(2)根据过氧化氢在二氧化锰的催化作用下分解生成水和氧气进行分析;
(3)根据实验室制取氨气的反应物是固体,氨气极易溶于水,密度比空气小进行分析.
解答 解:(1)通过分析题中所指仪器的作用可知,X是长颈漏斗;
(2)过氧化氢在二氧化锰的催化作用下分解生成水和氧气,化学方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
(3)实验室制取氨气的反应物是固体,氨气极易溶于水,密度比空气小,所以制取氨气应选择的发生和收集装置所有可能组合是AD或AF.
故答案为:(1)长颈漏斗;
(2)2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑或2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑或2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
(3)AD或AF.
点评 本题主要考查常见气体的发生装置与收集装置的探究,发生装置依据反应物的状态和反应条件选择,收集装置依据气体的密度和溶解性选择.


 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案科目:初中化学 来源: 题型:实验探究题
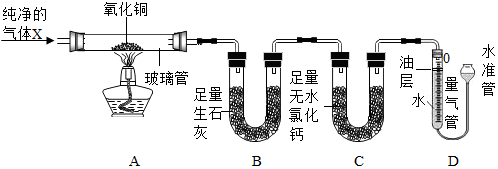
| 数据编号 测量项目 | Ⅰ | Ⅱ |
| 玻璃管(含药品)的质量/g | 54.40 | 53.92 |
| B装置(含药品)的质量/g | 104.00 | 104.54 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 物 质 | X | Y | Z | W |
| 反应前的质量(g) | 2 | 1 | 16 | 16 |
| 反应后的质量(g) | 12 | m | 8 | 14 |
| A. | 物质Y一定是该反应的催化剂 | |
| B. | 该反应的基本类型为分解反应 | |
| C. | 反应生成X的质量为12 g | |
| D. | 该反应中Z和W两种物质变化的质量比为4:1 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 点燃可燃性的气体之前要先验纯 | |
| B. | 用量筒量取一定量的液体时,视线应与液面最低处相齐 | |
| C. | 加热高锰酸钾制取氧气,用排水法收集完氧气,先将导管移出水面,后停止加热 | |
| D. | 将氢氧化钠固体直接放在托盘天平的托盘上称量 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
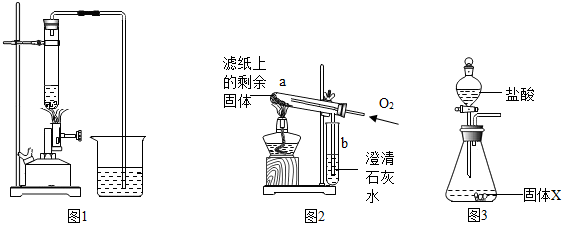
| 步骤 | 操作 | 主要现象 | 结论 |
| I | 取部分冷却后的固体X倒在滤纸上,用磁铁充分吸引. | 部分固体被吸引到磁铁上 | 可能有Fe或Fe3O4 |
| II | 取滤纸上的剩余固体少量,放入图2所示的试管a中,通入氧气,用酒精灯加热. | 固体剧烈燃烧,b中溶液变浑浊 | 一定有C. |
| III | 另取滤纸上的剩余固体少量,放入试管中,加入足量的稀盐酸. | 无明显现象 | 一定没有FeO和Fe2O3 . |
| IV | 取步骤I磁铁上的固体少量,放入试管中,逐滴加入稀盐酸. | 产生产生气泡. | 一定有Fe |
| V | 在步骤IV所得溶液中逐滴加入KSCN溶液. | 溶液不变红色 | 一定没有Fe3O4 |
| 步骤 | 操作 | 数据 |
| I | 重新取部分冷却至室温的固体X,称量其质量为m1. | m1=17.9g |
| II | 将称量好的固体X全部放入图3所示的锥形瓶中,称量整套装置及药品的质量为m2;打开分液漏斗旋塞,放入足量稀盐酸后关闭旋塞,待没有气泡产生并恢复至室温,再次称量整套装置及药品的质量为m3. | m2=317.9g m3=317.3g |
| III | 将锥形瓶中剩余的固体过滤、洗涤并干燥,称量其质量为m4. | m4=1.1g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com