
如图5-7所示,在试管和小气球中分别加入稀盐酸和一种常见的固体物质,然后将气球内的固体倒入试管中,观察到有气泡产生且气球胀大。请你根据上述实验回答下列问题:
(1)气球中加入的固体物质可能是 (至少答出两种不同类型的物质)。
(2)请用简单的实验方法,证明制得的气体的密度比空气大还是小
。
 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源:2013年江苏省宿迁市中考化学试卷(解析版) 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
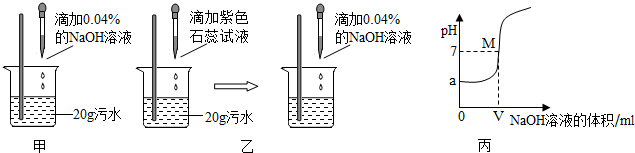
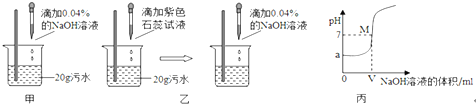
甲、乙、丙三位同学为一家化工厂的污水设计排污方案,请你就他们的探究过程回答有关问题.
Ⅰ.首先用pH试纸检测污水的酸碱性.三位同学分别进行如下实验:
甲:取pH试纸于玻璃片上,用玻璃棒蘸取待测液滴在pH试纸上,测得pH<7;
乙:取pH试纸于玻璃片上,先用蒸馏水湿润,再用玻璃棒蘸取待测液滴在pH试纸上,测得pH<7;
丙:取pH试纸直接浸入待测液中,测得pH<7.
(1)以上三位同学中操作规范的是________,污水显______(填写“酸性”、“碱性”或“中性”).
Ⅱ.利用中和反应原理测定污水中污染物(假设污染物为硫酸)的质量分数.
甲、乙两同学设计的方案如图甲、乙所示:

(2)甲同学取少量反应后的溶液于试管中,滴加几滴无色酚酞试液,酚酞呈红色,于是得出
“两种物质已恰好中和”的结论.你认为他的结论是否正确?________,理由是_____________.
(3)乙同学当观察到溶液由红色变成紫色现象时即认为两者恰好完全反应,发生的化学反应方程式为__________________________________________;若此时消耗NaOH溶液4g,则污水中硫酸的质量分数为_______%.(写出计算过程)
(4)实验过程中,NaOH溶液必须用胶头滴管逐滴加入,且要用玻璃棒不断搅拌,目的是
____________________________________________.
(5)丙同学利用连线在传感器上的计算机随机绘制出了如图丙所示的溶液的pH随所加的 的NaOH溶液体积变化的曲线.从曲线上可知污水的pH=______,M点表示的含义是 __________________,此时溶液中的溶质是_______.
(6)为了除去污水中的硫酸,你建议选用的原料是____________(填写序号).
A.NaOH B.Ca(OH)2 C.CuO D.Fe.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com