
【题目】(1)自然界中吸收大气中CO2的最重要环节是_____.
(2)科学家研究得到:海洋是吸收大量CO2的地方.如果CO2排放量继续增加,海洋将被“酸化”.请写出海洋酸化原因的化学方程式________.
(3)科学家目前正在研究将空气中过量的CO2和H2在催化剂和适量条件下转化成液态甲醇和水,反应的化学方程式:CO2+3H2 甲醇+H2O.则甲醇的化学式是______.
甲醇+H2O.则甲醇的化学式是______.
(4)已知20℃时,KCl的溶解度为34克,50℃时的溶解度为42.6克.通过以下实验操作得到溶液①至⑤:
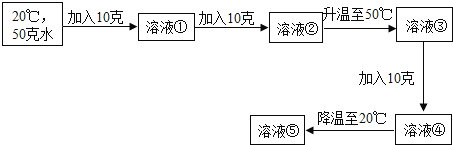
Ⅰ、上述实验所得溶液中,属于饱和溶液的是____;
Ⅱ、溶液④的质量为____克;
Ⅲ、溶液⑤中,溶质的质量分数为_____.
【答案】光合作用 CO2+H2O=H2CO3 CH4O或CH3OH ②④⑤ 71.3 25.4%
【解析】
(1)绿色植物的光合作用可以吸收二氧化碳,释放氧气;自然界中吸收大气中CO2的最重要环节是光合作用。故填:光合作用;
(2)二氧化碳和水反应生成碳酸,碳酸显酸性,化学反应方程式:CO2+H2O=H2CO3;故填:CO2+H2O=H2CO3;
(3)根据化学反应前后原子的种类和数目不变,由CO2+3H2 甲醇+H2O可知,反应前C、H、O原子个数分别为:1、6、2;反应后C、H、O原子个数分别为:0、2、1;故甲醇的化学式是CH3OH。故填:CH4O或CH3OH;
甲醇+H2O可知,反应前C、H、O原子个数分别为:1、6、2;反应后C、H、O原子个数分别为:0、2、1;故甲醇的化学式是CH3OH。故填:CH4O或CH3OH;
(4)由于氯化钾在20℃时的溶解度是34g,即100g水中最多溶解34g氯化钾,50g水中最多溶解17g氯化钾;因此在20℃时在50g水中加入10g氯化钾,氯化钾会全部溶解,得到的①溶液是20℃不饱和溶液;又加入10g氯化钾,由于在50g水中最多溶解17g氯化钾,因此这20g氯化钾只能再溶解17g,所以形成的②溶液是20℃饱和溶液;升温至50℃,由于氯化钾在50℃时的溶解度是42.6g,50g水中最多溶解21.3g氯化钾,因此后加入的氯化钾会全部溶解,而且形成的溶液③是50℃不饱和溶液,但又加入10g氯化钾,这10g氯化钾会再溶解1.3g,形成的溶液④是50℃饱和溶液,然后降温到20℃时,有晶体析出,形成溶液⑤是20℃饱和溶液.
Ⅰ、上述实验所得溶液中,属于饱和溶液的是②④⑤;
Ⅱ、溶液④的质量=50g+21.3g=71.3g;
Ⅲ、⑤是20℃饱和溶液,氯化钾在20℃时的溶解度是34g,即100g水中最多溶解34g氯化钾,溶质的质量分数为![]() ×100%≈25.4%。
×100%≈25.4%。
故填:②④⑤;71.3;25.4%。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:
【题目】某兴趣小组在相同条件下,将10.00g下列物质分别置于相同规格的烧杯,并敞口存放于空气中,烧杯中所有物质的质量随时间变化如下表,回答下列问题。
时间 | 质量/g | |||||
水 | 氯化钠溶液 | 盐酸 | 浓硫酸 | 氢氧化钠浓溶液 | 氯化钙溶液 | |
1天 | 8.16 | 8.62 | 8.64 | 11.18 | 9.38 | 10.25 |
2天 | 5.76 | 6.40 | 6.69 | 12.55 | 8.47 | 10.33 |
(1)图中能反映水在空气中放置时,发生变化的微观示意图是____(填标号)。
A 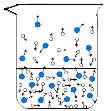 B
B 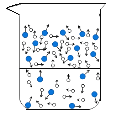 C
C 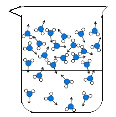 D
D 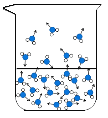
(2)为研制一种安全、环保的除湿剂,可选择上表中的____(填溶质的化学式)。
(3)为确认放置2天的盐酸浓度的变化,作如下的探究:取放置前后的盐酸分别滴入____溶液,再滴加_____相同的NaOH溶液,边滴加边振荡,当溶液颜色恰好由无色变为红色时,对比试管中溶液体积(如图所示),说明放置后盐酸溶质质量分数变____(填“大”或“小”)。

(4)氯化钠溶液放置2天后析出0.60g固体,则原氯化钠溶液是____(填“饱和溶液”或“不饱和溶液”)。(已知该温度下氯化钠的溶解度为36.0g)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙、丙三种固体物质的溶解度曲线如下图所示,请根据图示同答下列问题。
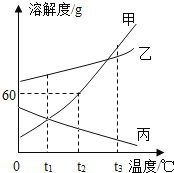
(1)丙物质的溶解度随温度的升高而_____。(填“增大”或“减小”)。
(2)t1℃时,将甲物质的饱和溶液升温到t3℃,所得溶液中溶质的质量分数_____。(填“变大”、“变小”或“不变”)。
(3)t2℃时,将100g水加入到盛有30g甲物质的烧杯中,充分溶解后得到不饱和溶液,若想使溶液恰好饱和,可采用的方法是:_____。
(4)t3℃时,甲、乙、丙三种物质的溶解度的由大到小的顺序是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】同学们在帮助老师整理实验室时,发现半瓶久置的氢氧化钙粉末[Ca(OH)2],大家决定用实验的方法探究这瓶粉末的组成。(资料:室温时,Ca(OH)2的溶解度是0.165g)
实验一:样品溶于水
取一药匙的样品,加入20mL水中充分溶解后,有沉淀物。
(1)有同学认为,该沉淀物可能是氢氧化钙,其推断的理由应该是_____。
(2)要证明样品已经变质生成碳酸钙,可往分离出的沉淀物中滴加稀盐酸,反应的化学方程式为_____。
实验二:测定样品中碳酸钙的质量分数
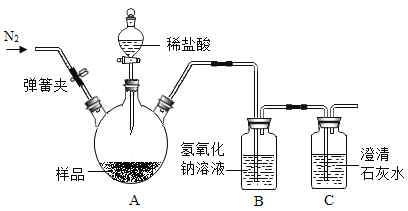
如图:打开弹簧夹,先通入N2一会儿,以排尽装置中含有的CO2.关闭弹簧夹,在A的样品中加入足量的稀盐酸。通过测定反应产生的二氧化碳气体的质量,可计算碳酸钙的质量分数(装置气密性已检验,夹持装置已省略)。
(3)装置B中发生反应的化学方程式是_____。
(4)实验结束后,还要再通一会儿N2,目的是_____。
(5)若C中无变化,经测定B瓶增重m g,要计算样品中碳酸钙的质量分数,还要预先测定_____的质量。
(6)若C中石灰水变浑浊,则测得的样品中CaCO3 的质量分数值将_____(填“偏高”、“偏低”或“不变”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图所示实验方法均可用来探究可燃物燃烧的条件.
(1)用如图所示装置进行实验,发生反应的化学方程式为______;该实验装置的缺点是(写一点)________ .
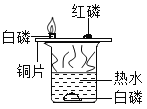
(2)另一同学用下图所示装置进行实验,得到以下实验事实:
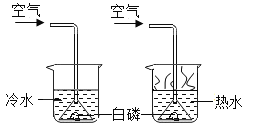
①不通空气时,冷水中的白磷不燃烧;
②通空气时,冷水中的白磷不燃烧:
③不通空气时,热水中的白磷不燃烧;
④通空气时,热水中的白磷燃烧.
该实验中,能证明可燃物通常需要接触空气才能燃烧的实验事实是_____(填序号,下同);能证明可燃物必须达到一定温度(着火点)才能燃烧的实验事实是 __________.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某物质4.6g在空气中完全燃烧生成8.8g二氧化碳和5.4g水,则关于这种物质的组成描述正确的是( )
A.该物质只含有碳元素和氢元素
B.该物质中碳元素与氢元素的质量比为4:1
C.该物质一定含有碳元素和氢元素,可能含有氧元素
D.该物质的分子中碳原子与氢原子的个数比为1:2
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室制取氧气,可供选的实验装置如下图所示。请回答:
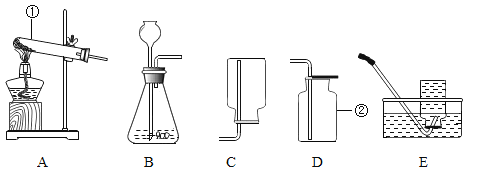
(1)指出编号仪器的名称:①____________,②__________。
(2)向气体发生装置内加入药品前,必须_________________;
(3)装置A中试管口稍向下倾斜的原因是__________________,若实验室选用A装置加热高锰酸钾制氧气,还需要_______________,反应的符号表达式为_________________,若用装置D收集氧气,验满的方法是___________。实验室用过氧化氢溶液制取氧气,应选的发生装置是_______(填字母序号)。
(4)乙炔(C2H2)又称电石气,是一种无色、无味、密度比空气略小,不溶于水的气体;工业上常用它燃烧产生的高温来切割和焊接金属;实验室用电石(固体)与水反应制取乙炔。你认为制取乙炔应选择的发生装置是________(填字母序号);收集装置是_____________(填字母序号)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】A~H是初中化学常见的八种物质,它们之间的转化关系如图所示。其中A和C常温下是液体,A和C、E和G的元素组成相同H是世界上年产量最高的金属(图中“→”表示物质间存在的转化关系,反应条件已略去)。A的化学式为__________;物质B的一种用途为________;反应③的化学方程为_________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com