
分析 把生锈的铁钉放到足量的稀盐酸中,表面的铁锈先与盐酸反应,当铁锈反应完后,铁继续与盐酸反应;铁锈的主要成分为三氧化二铁.
解答 解:铁锈的主要成分是Fe2O3,它会与稀盐酸反应,方程式为:Fe2O3+6HCl=2FeCl3+3H2O,生成的Fe3+显黄色,当铁锈反应完后,铁继续与盐酸反应,方程式为:Fe+2HCl=FeCl2+H2↑,所以会观察到有气泡冒出.
故答案为:铁锈溶解、生成黄色溶液; Fe2O3+6HCl=2FeCl3+3H2O; 有气泡冒出; Fe+2HCl=FeCl2+H2↑.
点评 对于实验过程中出现的现象,同学们要会灵活应用化学知识去作答,明确在置换反应中,铁表现出正二价,正二价的金属铁溶液呈浅绿色,而三价铁溶液呈黄色.


 字词句段篇系列答案
字词句段篇系列答案科目:初中化学 来源: 题型:多选题
| A. | a=2b | B. | 2a=b | C. | 3a=d | D. | a+2b=2c+d |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
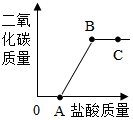 取实验室中部分变质的NaOH样品配成溶液,向其中滴加稀盐酸,绘制出生成的CO2的质量与加入的盐酸的质量关系如图所示,下列有关说法正确的是( )
取实验室中部分变质的NaOH样品配成溶液,向其中滴加稀盐酸,绘制出生成的CO2的质量与加入的盐酸的质量关系如图所示,下列有关说法正确的是( )| A. | OA段没有发生任何化学反应 | |
| B. | A点溶液中的溶质只有NaCl | |
| C. | C点的溶液的pH=7 | |
| D. | B点表示加入的盐酸与原溶液中的溶质恰好完全反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com