
【题目】将盛有等质量、等质量分数且足量的稀盐酸的两只烧杯,放在托盘天平的左右两盘,天平平衡。在左盘烧杯中加入10克碳酸钙,若要使天平重新平衡,则右盘烧杯中应加入的物质可能是
A.10克碳酸钾和碳酸钠B.10克碳酸镁和碳酸钠
C.10克氧化铜D.10克镁粉和铜粉
【答案】B
【解析】
加入10g碳酸钙,设左盘增加的质量为x
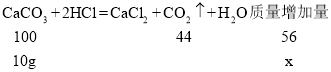
![]() x=5.6g
x=5.6g
A、碳酸钾和稀盐酸反应:![]() ,碳酸钾的相对分子质量是138,由化学方程式可知,如果10g全部是碳酸钾,生成二氧化碳的质量小于4.4g, 质量增加量大于5.6g;
,碳酸钾的相对分子质量是138,由化学方程式可知,如果10g全部是碳酸钾,生成二氧化碳的质量小于4.4g, 质量增加量大于5.6g;
碳酸钠和稀盐酸反应:![]() ,碳酸钠的相对分子质量是106,由化学方程式可知,如果10g全部是碳酸钠,生成二氧化碳的质量小于4.4g, 质量增加量大于5.6g;
,碳酸钠的相对分子质量是106,由化学方程式可知,如果10g全部是碳酸钠,生成二氧化碳的质量小于4.4g, 质量增加量大于5.6g;
故无论碳酸钾和碳酸钠以何种比例混合,天平都不会平衡,不符合题意;
B、碳酸镁和稀盐酸反应:![]() ,如果10g全部是碳酸镁,碳酸镁的相对分子质量是84,由化学方程式可知,如果10g全部是碳酸镁,生成二氧化碳的质量大于4.4g, 质量增加量小于5.6g;由A可知,如果10g全部是碳酸钠,质量增加量大于5.6g,故天平可能会平衡,符合题意;
,如果10g全部是碳酸镁,碳酸镁的相对分子质量是84,由化学方程式可知,如果10g全部是碳酸镁,生成二氧化碳的质量大于4.4g, 质量增加量小于5.6g;由A可知,如果10g全部是碳酸钠,质量增加量大于5.6g,故天平可能会平衡,符合题意;
C、氧化铜与稀盐酸反应生成氯化铜和水,无气体生成,右盘增加量就是10g,天平不平衡,不符合题意;
D、假设10g全部是镁粉,镁与稀盐酸反应:![]() , 生成氢气的质量小于4.4g,质量增加量一定大于5.6g,铜与稀盐酸不反应,故无论镁粉和铜粉以何种比例混合,质量增加量都大于5.6g,天平不会平衡,不符合题意。
, 生成氢气的质量小于4.4g,质量增加量一定大于5.6g,铜与稀盐酸不反应,故无论镁粉和铜粉以何种比例混合,质量增加量都大于5.6g,天平不会平衡,不符合题意。
故选B。


科目:初中化学 来源: 题型:
【题目】某化学兴趣小组欲测定某氯化镁样品中MgCl2的含量(杂质为NaCl),甲、乙、丙三位同学分别取10g样品溶于一定量的水中,得到45.8g、45.8g、50g三份样品溶液,再分别加入溶质质量分数相同的氢氧化钠溶液,所得实验数据如表:
甲同学 | 乙同学 | 丙同学 | |
所用样品溶液质量(g) | 45.8 | 45.8 | 50 |
加入氢氧化钠溶液质量(g) | 70 | 60 | 60 |
反应得到沉淀的质量(g) | 5.8 | 5.8 | 5.8 |
试回答下列问题:
(1) 同学的实验数据显示了MgCl2和NaOH恰好完全反应。
(2)计算MgCl2和NaOH恰好完全反应时所得溶液溶质的质量分数。(结果精确到0. 1%)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列图象能正确反映对应变化关系的是( )
|
|
|
|
A.向100g 10%的稀盐酸中逐滴加入100g 10%的氢氧化钠溶液 | B.将t3℃时等质量的甲、乙、丙的饱和溶液分别降温到t1℃,所得溶液的质量丙>乙>甲 | C.向盛有一定量硫酸铜溶液的烧杯中逐渐加入铁粉至过量 | D.向等质量等浓度的稀硫酸和稀盐酸中各加入铁粉至过量 |
A.AB.BC.CD.D
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】元素及其化合物知识是初中化学的基础。
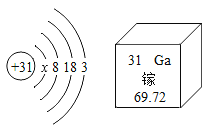
(1)如图是一种元素的原子结构示意图及该元素在周期表中的部分信息。则该元素属于_____ (填 “金属”或“非金属”)元素,x的数值是_____,该元素的氢氧化物的化学式为_____.
(2)如图是以化合价为纵坐标,物质类别为横坐标所绘制的“价类图”。图中A~F是初中化学中的常见物质,它们所含元素为H、O、S、Cu中的一种或几种,每种物质中都有一种元素的化合价与纵坐标的数值对应。图中“→”表示物质间的转化关系。请分析并回答下列问题:
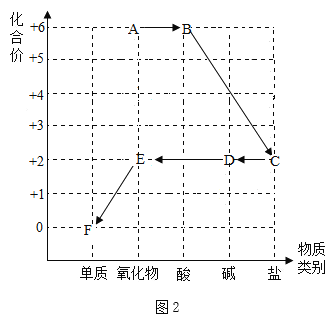
①写出化学式: A______;D______ 。
②通过中和反应实现B→C的化学方程式为_______
③E→F的化学方程式为____
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】将氯化钠和氯化铁的固体混合物40g完全溶于101.4g水中形成溶液,再将100g一定溶质质量分数的氢氧化钠溶液分5次加入到该溶液中,充分反应后,测得的实验数据如下表所示:
实验次数 | 1 | 2 | 3 | 4 | 5 |
加入氢氧化钠溶液质量/g | 20 | 20 | 20 | 20 | 20 |
共生成沉淀的质量/g | 5.35 | 10.7 | m | 21.4 | 21.4 |
求:(1)表中m的值为________。
(2)原混合物中氯化铁的质量___________。
(3)恰好完全反应时,所得溶液的溶质质量分数是____。(写出计算过程,结果精确到0.1%)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某合金主要成分为Zn、Fe、Cu及这三种金属的少量氧化物。利用该合金制成的机械零件废弃物制取高纯度ZnO,其部分工艺流程如图所示。请回答:
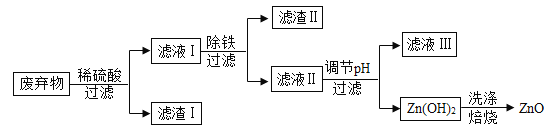
已知:Zn(OH)2溶于强碱形成可溶性盐。
(1)滤渣Ⅰ中一定有_______。
(2)加酸溶解废弃物时,需要通风并远离火源,其原因是_____。此过程中Zn还能起到除铜作用,除铜的化学方程式为____ ,现象是____.
(3)调节pH可用NaOH,但不能过量,其原因是________。
(4)焙烧Zn(OH)2发生分解反应的化学方程式为_______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】食盐是维持人体正常生理活动的重要物质,同时也是重要的化工原料。医学上的生理盐水是用NaCl配置的。下图是配制溶质质量分数为10%的NaCl溶液的实验操作示意图:
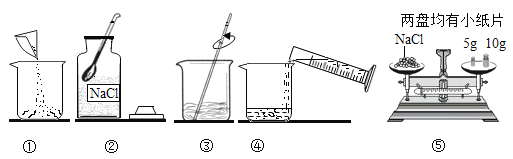
(1)用上图表示的序号表示配制溶液的正确操作顺序_____。
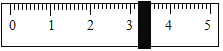
(2)称量NaCl时,天平平衡后的状态如图⑤所示,游码标尺示数见图,则需量取水质量为_____。
(3)称量NaCl质量完毕放回砝码时,发现有一个砝码生锈,若其他操作步骤正确,则所配溶液的溶质质量分数_____(填“大于”、“小于”或“等于”)10%。
(4)实验结束后称量获得的精盐,并计算精盐的制得率,发现制得率较低,其可能原因是_____(填序号)。
A 食盐没有全部溶解即过滤 B 蒸发时食盐飞溅剧烈
C 蒸发后,所得精盐很潮湿 D 器皿上沾有的精盐没全部转移到称量纸上
(5)同学们用上述配制好的溶液再进行配制85g的2%氯化钠溶液:
①需要10%的氯化钠溶液_____g。
②配制过程中的操作步骤为:计算、_____、_____、装瓶。
(6)用氯化钠和碳酸氢铵(![]() )可制备碳酸氢钠和氯化铵(
)可制备碳酸氢钠和氯化铵(![]() ),该反应可表示为:
),该反应可表示为:![]() 。20℃时,按上述化学方程式中反应物的质量比,向100g水中加入11.7gNaCl和15.8g
。20℃时,按上述化学方程式中反应物的质量比,向100g水中加入11.7gNaCl和15.8g![]() 。理论上从溶液中析出晶体的质量为_____g。
。理论上从溶液中析出晶体的质量为_____g。
资料:20℃时四种物质的溶解度如下,假设它们同时溶解在水中各自的溶解度不变。
物质 | NaCl |
|
|
|
溶液度/g | 36.0 | 21.6 | 37.2 | 9.6 |
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列实验方案不能达到实验目的是![]()
A.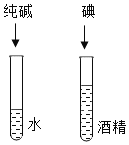 探究影响溶解度的因素
探究影响溶解度的因素
B.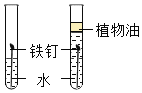 探究铁生锈与氧气有关
探究铁生锈与氧气有关
C.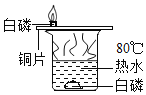 证明可燃物燃烧需要氧气
证明可燃物燃烧需要氧气
D.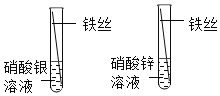 比较Fe、Ag、Zn的金属活动性
比较Fe、Ag、Zn的金属活动性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com